Publié le 25 oct 2021Lecture 9 min
Contrôle des CTO en imagerie endocoronaire - Le SAV de l’angioplastie complexe
Sébatstien LEVESQUE et coll.*, E. LARRIEU-ARDILOUZE, J. MERGY, A. RAMONATXO, L. CHRISTIAENS Centre cardiovasculaire, USIC-coronarographie, CHU de Poitiers
APPAC 2021
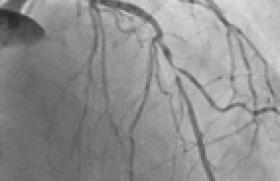
L’imagerie endocoronaire est un outil fiable et reproductible dans l’analyse fine du résultat d’une procédure d’angioplastie. Parce que le traitement des occlusions coronaires chroniques (CTO) représente certainement un des plus grands progrès techniques interventionnels récents, mais avec un recul encore limité, nous vous expliquons ici notre stratégie de surveillance de ces patients basée sur notre expérience.
La progression des techniques de recanalisation est due autant aux cardiologues interventionnels qu’aux départements recherche et développement des entreprises de matériel médical. Grâce aux gammes de guides dédiés en passant par les microcathéters simple, double, triple lumière ou de réentrée, le laser et les extensions de cathéter, tous ces progrès ont relégué à la préhistoire de l’angioplastie la classification modifiée ACC/AHA de 1990 des lésions coronaires en fonction de leur succès prévisionnel.
La contribution de l’imagerie endocoronaire ne doit pas être sous-estimée. En permettant de dépasser le critère insuffisamment pertinent de la seule analyse clinique, nous avons su corriger progressivement nos techniques et notre qualité de stenting dans une optique de perfection « mécanique » et clinique. L’intérêt biomécanique du DK crush ou d’une séquence de re-POT dans une bifurcation est un bel exemple de la quête de « l’idéal de l’apposition de mailles ».
Nous essaierons de détailler ici en quoi l’imagerie endocoronaire peut nous faire progresser et nous aider à parfaire nos techniques d’angioplastie de CTO. Si l’objectif d’un intérêt clinique de mortalité sera difficile à démontrer (après 3 décennies et demie de stent, on se bat encore pour la pertinence de notre pratique dans l’angor stable…), l’objectif « technique » à long terme de la CTO est parfaitement clair : garder un vaisseau perméable, aux fonctions endothéliales et de conductance les plus préservées possible.
Passons sur le concept de preuves cliniques et de médecine basée sur les preuves.
Rien ne démontre aujourd’hui l’intérêt clinique d’une telle démarche. Car, s’il était simple il y a 80 ans de démontrer sur quelques dizaines de patients l’intérêt de la pénicilline dans le choc septique versus rien… – encore que la science du chiffre et de la statistique se heurtait alors au scepticisme et aux croyances théologiques –, je crains qu’il ne nous faille une dizaine d’années de suivi et des dizaines de milliers de patients pour démontrer que l’imagerie endocoronaire dans le suivi des CTO a un impact significatif sur la mortalité. Encore une fois, nous peinons toujours à convaincre dans l’angor stable.
Mais peut-être que notre manière de faire de la science mérite une cure de jouvence et que nos standards d’interprétation statistiques peuvent souffrir quelques raccourcis pour nous permettre de croire à la logique de notre démarche. Et quitte à passer 2 heures à désobstruer une artère, autant tout faire pour que le résultat soit pérenne. De la même façon, nous ne débattrons pas dans ce texte de l’intérêt (encore controversé ?) de désobstruer ces CTO, considérant comme acquis que l’on va plus loin, plus vite, plus longtemps et avec moins d’accidents quand tous les pneus du véhicule sont bien gonflés ! En cas de doute, on put se référerer aux études de Godino, Mehran, George, Byeong-Keuk Kim…
HISTOPATHOLOGIE DE LA CTO(1)
Il n’y a évidemment aucune étude in vivo mais simplement des analyses ex vivo anatomopathologiques qu’il faut assimiler pour appréhender le défi de la revascularisation d’une CTO et comprendre l’impact sur les difficultés potentielles de cicatrisation. L’occlusion apparaît après une rupture de plaque athéromateuse avec formation bidirectionnelle de thrombus. Celui-ci finit par s’organiser, restant « soft » au début puis progressivement remplacé par du collagène et du tissu fibreux dense. Le segment occlus peut être divisé en trois avec au milieu, un segment intermédiaire encadré par la chape (cap) proximale qui est décrite comme plus fibrocalcique que la chape distale. L’architecture artérielle et les tuniques qui la composent, qui maintiennent l’élasticité et la résistance à la pression sanguine se déstructurent alors au profit de cellules inflammatoires (infiltration de lymphocytes et monocytes macrophages). La composition de la plaque intimale change avec la durée d’occlusion, passant de cellules spumeuses riches en cholestérol qui s’organisent et évoluent vers une fibrocalcification. Deux types de néovascularisation s’y développent : des microvaisseaux endothélialisés traversant de part en part l’occlusion et des microcapillaires reliant les vasa vasorum au sein de la plaque dont le nombre semble augmenter avec le vieillissement de la CTO.
LES TECHNIQUES D’ANGIOPLASTIE DE CTO
Elles peuvent aboutir à la mise en place de stents en position non conventionnelle dans l’artère. Sur des longs trajets de recanalisation, il est difficile de pouvoir affirmer que le passage du guide se fera strictement de vraie lumière à vraie lumière. Certaines techniques de recanalisation, bien récapitulées par l’équipe de Brilakis(2), utilisent volontairement la création d’un néochenal dans la média et sont souvent mécaniquement responsables d’un stent en position pour toute ou partie extraluminale… La notion de trajet intraluminal est complexe puisque, à la lecture du paragraphe d’anatomopathologie, on comprend bien que l’intima au sein d’une lésion ancienne se désagrège et que les tuniques concentriques élastiques constrictives sont remplacées par une bouillie athéromato-fibrocalcique dont les propriétés vasomotrices résiduelles sont inconnues.
Une CTO recanalisée avec un résultat angiographique très satisfaisant ne permet pas de préjuger de la qualité de sa fonction endothéliale.
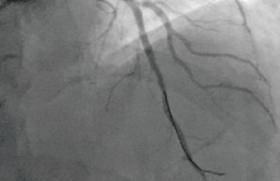
L’objectif principal est de récupérer une fonction de conductance du vaisseau épicardique se maintenant à long terme (figure 1). La récupération d’un néoendothélium biologiquement actif qui recouvrira les mailles des stents est une hypothèse non vérifiée dont l’intérêt sur l’ischémie myocardique reste à démontrer.
La position du stent au sein de l’artère
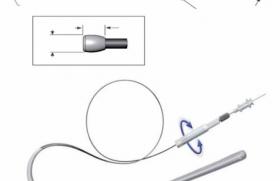
C’est un des paramètres fondamentaux et certainement sous-estimé. Le stent peut être en position centrale (comme une angioplastie « conventionnelle », répartissant de manière homogène tout autour de lui les tuniques élastiques de la média et leur gardant leur propriété de constriction. Mais dans le cas où on utilise des techniques de recanalisation, laissant la possibilité au matériel de s’enfoncer profondément dans la média jusqu’à se rapprocher de l’adventice (large knuckle antérograde ou rétrograde, reverse CART, dissection réentrée plus ou moins contrôlée), le stent pourra être mis en place en position excentrée dans l’artère et créer, en regard de la paroi la plus amincie, des zones de faiblesse équivalente à une hernie dans une chambre à air (figure 2).
Ce phénomène n’est, pour l’instant, qu’une simple hypothèse mécanique logique se basant sur le constat d’évolution inhabituelle après certaines CTO. Il est malgré tout légitime de s’interroger sur le devenir des stents, initialement destinés par leur plateforme, leur produit actif et leur polymère à un usage « conventionnel », qui sont placés dans des artères profondément remaniées et architecturalement délabrées : on peut s’attendre à une évolution et une réendothélialisation inhabituelles. Le stent à plateforme métallique (encore inévitable en 2021) doit donc être de diamètre adapté, bien déployé et bien apposé pour bien cicatriser. Autant d’impératifs que la seule angiographie ne peut prouver.
L’IMAGERIE ENDOCORONAIRE INFRAROUGE
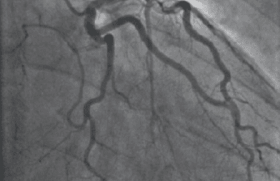
C’est la plus adaptée pour vérifier l’évolution de ces stents. Actuellement , ni l’imagerie en coupes ni notre bonne vieille angiographie coronaire n’ont une résolution suffisamment précise pour explorer à 10 microns près ce que sont devenus nos bouts de métal. Vous utiliserez l’imagerie que vous maîtrisez le mieux, mais à la lumière de notre expérience, l’OFDI (optical frequency domain imaging) de Terumo nous semble la technique la plus adaptée au vu de ses qualités de longueur d’acquisition, fiabilité des images et crossabilité des lésions (figure 3). Depuis 15 ans, l’antique mais précurseur console LightLab et son ballon d’occlusion qui nous ont donné les premières images d’OCT a évolué. Actuellement, avec 15 à 18 ml de contraste et des paramètres de retrait adapté, il est possible d’analyser 150 mm d’artère en moins de 4 secondes. En contrôlant ainsi vos CTO, vous serez surpris, comme nous le sommes, devant tant « d’affreuseries » endocoronaires.
C’est le sujet qui a occupé les investigateurs de l’étude PERFECTO dont les derniers résultats sont en cours d’analyse. Après avoir désobstrué et obtenu un résultat angiographique et OFDI/OCT optimal dans des procédures de CTO complexes, les patients étaient systématiquement recontrôlés à 3 mois en angiographie et OFDI/ OCT. Si le but initial de l’étude était d’étudier la réendothélisation des stents, il s’est avéré que ce SAV de la CTO allait nous offrir un imagier assez complet de la malapposition acquise qui sera au coeur de nos résultats(3).
CONTRÔLE DES CTO À 3 MOIS, QUE VA-T-ON TROUVER ?
En angiographie
• Un résultat parfait. Tant mieux pour votre patient. Ne regrettez rien. Tant que ne sont pas compris les mécanismes de mauvaise évolution, mieux vaut un contrôle simple n’aboutissant pas à un geste complémentaire que de méconnaître une anomalie corrigeable qui incrémente le risque de réocclusion.
• Une réocclusion de l’artère. Le risque de réocclusion à 3 mois dans PERFE-CTO était extrêmement bas, se situant seulement à 2 % et est probablement lié à la qualité et la viabilité du lit d’aval récupéré. Ces réocclusions seront souvent asymptomatiques. Vous choisirez alors raisonnablement de ne pas proposer une nouvelle tentative.
• Une lésion distale persistante. Le lit d’aval va reprendre du calibre (augmentation en IVUS du diamètre luminal distal d’environ 20 % selon Sun Jin Hong(4)) et peut révéler au sein de zones initialement sous-perfusées d’authentiques lésions résiduelles que vous traiterez ainsi en différé au plus juste de leur longueur et de leur calibre.
• Une resténose précoce liée le plus souvent à des défauts d’expansion.
En OFDI/OCT
• Une edge dissection. Qu’elles soient proximales ou distales, ces lésions persistantes ne cicatrisent pas toujours toutes seules et sont source de réocclusion. Elles peuvent nécessiter un stenting additionnel(5).
• Un retard d’endothélialisation des struts du stent qui devra être pris en compte dans la durée de la double antiagrégation plaquettaire (DAPT).
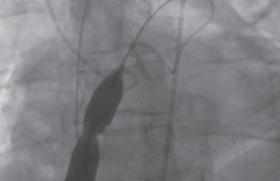
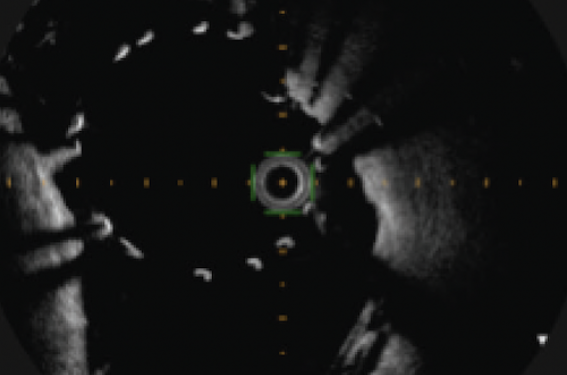
• Des défauts d’apposition acquis de stents. Il s’agit de défauts d’apposition non présents à la fin de la procédure. Ces défauts semblent fréquents mais d’intensité variable. Ils sont plus fréquents dans les techniques de recanalisation sous-intimale, 13,6 % versus 6,6 % pour la recanalisation intraplaque (registre ISAR-OCTCTO)(6). Ce phénomène concernait 30 % des patients de PERFE-CTO. Il était présent à des degrés variables avec parfois des images préoccupantes, à l’avenir incertain (figure 4).
Mais le problème de la définition de la malapposition d’un stent est qu’elle est finalement assez sommaire parce qu’uniquement binaire. Sur des mailles de stent dont l’épaisseur est maintenant relativement homogène (aux environs de 80 microns), Lorenz Räber définit la malapposition comme une distance maille-paroi de l’artère de plus de 400 microns(5). Mais cette description ne prend en compte qu’un seul critère. En conséquence, la malapposition existe… ou pas. À la relecture de plusieurs centaines de malappositions, il s’avère que le phénomène mérite peut-être d’être décrit de manière plus détaillée en incluant d’autres paramètres qui génèreront à terme une classification avec la conduite à tenir associée (figure 5). En l’absence actuelle de recommandations précises, nous laissons à votre discrétion le soin de corriger au mieux ces anomalies, avec comme limite la capacité maximale d’expansion du stent. Affaire à suivre…
* E. LARRIEU-ARDILOUZE, J. MERGY, A. RAMONATXO, L. CHRISTIAENS
Centre cardiovasculaire, USIC-coronarographie, CHU de Poitiers
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :