
Publié le 31 aoû 2011Lecture 11 min
L’ABC de l’OCT
S. LEVESQUE, G. SOUTEYRAND, P. MOTREFF, pôle de cardiologie, USIC, Hôpital de Montpied, Clermond-Ferrand
La tomographie par cohérence optique (OCT : Optical Coherence Tomography) est une technique d’imagerie utilisée depuis les années 1990 dans des spécialités évoluant dans des milieux transparents. L’OCT s’appuie sur la réflexion d’une lumière infrarouge sur les tissus biologiques ou matériels prothétiques.
Le rayon lumineux est divisé depuis sa source en 2 faisceaux identiques : l’un détourné par un miroir servira de référence, l’autre étant projeté vers le tissu étudié. Ce deuxième faisceau va être transformé après réflexion (en fonction de la distance et de la nature du tissu éclairé) et l’interférence existant entre les 2 faisceaux initialement identiques sera traitée pour créer l’image. La source lumineuse est animée d’un mouvement de rotation et de retrait automatisé donnant une image en coupe d’un segment vasculaire puis une reconstruction tridimensionnelle.
La dernière génération d’OCT permet une acquisition rapide (jusqu’à 54 mm en 2,7 secondes) d’un long segment de coronaire avec une meilleure pénétration du signal en profondeur. La première génération d’OCT nécessitait une occlusion en amont de la zone à étudier du fait d’une vitesse de retrait de 1 mm/s. Grâce à un pullback plus rapide, cette occlusion n’est plus nécessaire et on peut ainsi analyser désormais les vaisseaux de gros calibre et les portions proximales des coronaires. Néanmoins il est nécessaire d’être en milieu transparent car la lumière infrarouge ne pénètre pas dans un milieu sanguin. Une perfusion simultanée de produit de contraste (chaque pullback nécessitant 8 à 15 ml de perfusion) est donc nécessaire. Après un abord en 6 F, le montage de la fibre sur un guide d’angioplastie standard (0,014’’) fait sous couvert d’héparine (50 UI/kg) et d’antiagrégants plaquettaires, comme pour une angioplastie. L’extrémité radio-opaque est positionnée en aval de la zone à explorer. La perfusion de contraste peut être manuelle ou réalisée via un injecteur automatique (réglage Acist dans notre centre : 10 à 15 ml à 3,5 à 4 cc/s — PSI 300 selon la coronaire étudiée).
Sous couvert d’une réalisation rigoureuse et d’une interprétation par une équipe entraînée, l’OCT est réalisable dans presque toutes les situations de la cardiologie interventionnelle coronaire. Nous utilisons l’OCT dans notre centre depuis septembre 2006. Grâce aux progrès technologiques, cette technique n’est plus utilisée uniquement pour les projets de recherche mais bien pour des situations quotidiennes. Nous rapportons ici notre expérience dans ce domaine sous forme de 11 figures résumant les situations les plus fréquemment rencontrées.
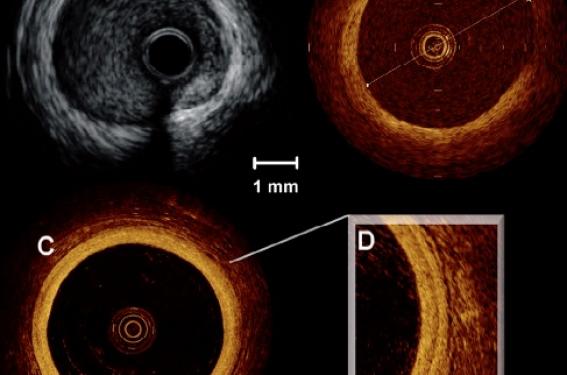
Figure 1. Différence de définition sur des artères de 4 mm de diamètre entre l’IVUS (A), la première génération d’OCT M5 (B) et la génération actuelle d’OCT C7 (C). Le grossissement de la paroi artérielle (D) permet aisément d’identifier les 3 couches pariétales. La fibre OCT, au milieu de l’image C, d’une largeur de 2,8 F, est amenée dans l’artère sur un guide d’angioplastie qui a été ici retiré.
Figure 2. Analyse anatomique en OCT. A : L’image de gauche et celle de droite sont à la même échelle. À gauche, une branche diagonale de 2 mm de diamètre et à droite un pontage mammaire gauche (stenté) de 5,7 mm de diamètre. Dans les petits comme les gros vaisseaux, y compris les pontages et le tronc commun, la définition peut être excellente. B : L’analyse des artères est également possible en coupes longitudinales dites long view. À gauche, le départ d’une petite branche collatérale à partir d’une IVA dont la naissance se fait avec un angle de 90°, à droite la naissance d’une branche marginale de la circonflexe naissant avec un angle de 40°. C : Il s’agit de l’analyse d’une trifurcation proximale IVA-CX- Bissectrice (angiographie de référence en spyder view). En coupes longitudinales, on visualise le départ des branches collatérales les unes par rapport aux autres. D : L’analyse et les mesures facilement réalisables sur une artère grâce à la reconnaissance automatique des contours (surface, diamètre minimal, maximal et moyen) sont dépendantes d’une bonne calibration de la fibre. Ce réglage, manuel sur les premières générations, est désormais automatisé.
Figure 3. Artéfacts en OCT. A : Artéfact lié à l’excentration de la fibre dans un vaisseau de grande dimension. La paroi artérielle la plus éloignée de la fibre n’est pas analysable et apparaît beaucoup moins contrastée. B : Artéfact lié à un flush insuffisant. La lumière artérielle n’est pas complètement noire, il persiste des volutes sanguines pouvant passer pour du thrombus flottant, diminuant la qualité du signal et gênant l’interprétation. C : Artéfact de rotation. On observe une cassure artéfactuelle de la continuité pariétale (flèche) liée au déplacement brutal de la fibre par rapport à la coronaire. Cet artéfact particulièrement marqué avec les anciennes consoles est aujourd’hui moins fréquent.
Figure 4. Analyse de la plaque en OCT. A : Sur la coupe de gauche, on visualise dans le quadrant inférieur gauche une plaque athéromateuse dont on peut mesurer les dimensions, la surface et l’arc (ici : 90°). Il est peu fréquent de visualiser la partie postérieure des plaques lipidiques. Sur l’agrandissement de droite, on mesure précisément l’épaisseur de la chape fibreuse (ici : 0,52 mm). B : Plaque athéromateuse non sténosante (flèche) en regard d’une bifurcation. C : Plaque hétérogène avec cônes d’ombres postérieurs (flèches) pouvant évoquer une plaque calcifiée. D : Coupe d’une occlusion chronique de l’IVA. La fibre est dans le chenal principal et on distingue autour de multiples microchenaux (flèches). E : Image d’une large plaque athéromateuse à faible signal intéressant la moitié supérieure de la paroi artérielle. Au sein de la plaque on distingue des zones vides de signal pouvant correspondre à la vascularisation de la plaque (flèche). On voit qu’il est difficile d’estimer la plaque en profondeur, ce qui est une limite de l’OCT par rapport à l’IVUS.
Figure 5. Exemple de sizing d’une lésion. A : 3 coupes axiales d’une artère IVA réalisées en aval d’une sténose (à gauche), au plus serré de la sténose (au milieu) et en amont (à droite). Le diamètre moyen en aval est de 3,38 mm et de 3,48 mm en amont. La surface luminale minimale est de 3,30 mm2 pour une surface de référence de 8,98 mm2 (sténose calculée en surface de 72 %). B : La même lésion est mesurée en coupe longitudinale et la longueur de sténose est de 15,1 mm. C : À la suite de ces mesures, on implante un stent de 3,5 mm de diamètre et de 18 mm de longueur dont on visualise le résultat en long view.
Figure 6. Imagerie du syndrome coronarien aigu. A : 4 coupes axiales réalisées au 5e jour de syndrome coronarien aigu montrant des ruptures de plaques athéromateuses (flèches) avec détersion du corps lipidique expliquant le vide de signal. B : Rupture de plaque au sein d’une néoprolifération athéromateuse intrastent. On visualise au-delà de la plaque détergée les struts du stent (flèche). C : Thrombose tardive intrastent. Il n’est pas possible sur cette image d’identifier une rupture de plaque au sein du signal hétérogène diffus intraluminal correspondant vraisemblablement à du thrombus. D et D’ : Images agrandies long view de deux IVA différentes mettant en évidence des ruptures de plaque avec détersion de leur contenu (flèches). E : Hématome sous-adventitiel survenu chez une femme de 43 ans, par ailleurs exempte de plaques athéromateuses. La fibre d’OCT est dans le vrai chenal. L’étoile montre l’hématome sous-adventitiel. Le clivage est particulièrement visible sur l’image de droite. L’hématome n’est pas toujours bien visualisé en OCT car il existe une perte de signal en profondeur.
Figure 7. Imagerie du syndrome coronarien aigu : le thrombus. A : Image réalisée en phase aiguë d’infarctus. Probable thrombus avec contour de la paroi irrégulier. On croit distinguer dans le quart supérieur gauche une rupture de plaque. A’ : Image réalisée chez le même patient après thromboaspiration. On visualise cette fois parfaitement la rupture de plaque (flèche). B : Thrombus tapissant la lumière artérielle de manière circonférentielle. Perte d’information en profondeur due au cône d’ombre du thrombus. C : Dans le quadrant inférieur, il y a 2 images de thrombi. L’un flottant dans la lumière sans attache à la paroi artérielle avec un cône d’ombre postérieur. L’autre est accolé à la paroi, la profondeur au-delà n’est pas analysable. D : Le quadrant supérieur gauche est occupé par un thrombus intraluminal empêchant toute pénétration du signal en profondeur. Certains auteurs s’accordent à penser qu’il s’agit là de thrombus rouge, plus opaque de par sa composition que le thrombus blanc. E : Image de thrombus moins opaque que la précédente, sans perte d’information en profondeur. Il pourrait s’agir de thrombus blanc.
Figure 8.
Cas n° 1 : Dissection iatrogène spiroïde de la coronaire droite. A : Coupe axiale OCT au genou supérieur de la CD. La lumière artérielle est occupée par la fibre OCT et 2 guides. Le repère étoilé est situé dans le faux chenal, non compressif en forme de croissant. A’ : Coupe axiale en IVUS, au même endroit que la coupe A. On peut voir que la lumière artérielle est moins nette qu’en OCT. B : Coupe axiale OCT au segment vertical de la CD. Le faux chenal est désormais compressif, la profondeur n’est plus analysable, le faux chenal n’est plus visible (?). B’ : Coupe axiale en IVUS, au même endroit que la coupe B. La profondeur et le faux chenal sont toujours analysables avec une lumière artérielle comprimée. Cas n° 2 : Dissection spontanée de l’IVA. C : Coupe axiale OCT en regard de la porte d’entrée de la dissection. Le faux chenal est symbolisé par une étoile. C’ : Coupe axiale en regard de la bifurcation IVA-Diag. La diagonale est alimentée par le vrai chenal.
Figure 9. Imagerie immédiatement après stenting. Nous résumons ici les différents résultats possibles.
A : Parfaite apposition des mailles sur la paroi artérielle avec une répartition homogène sur la circonférence. B : Parfaite apposition des mailles sur la paroi artérielle avec une répartition très inhomogène sur la circonférence et arc de couverture total de seulement 180° environ. C et C’ : Malapposition précoce intéressant le quadrant inférieur. Les mailles à distance de la paroi sont visibles en coupes axiales (flèches en C) et en long view (flèches en C’). Le diagnostic de malapposition des mailles impose de connaître l’épaisseur des mailles correspondant au stent étudié. D : Malapposition quasi circonférentielle. Les mailles les plus malapposées sont à 0,24 mm de la paroi artérielle (image zoomée). E : Sous-déploiement du stent en regard d’une zone fibreuse. L’aspect ovoïde de l’artère est évocateur. La surface luminale est de 4,01 mm2 pour une surface plus en aval de 6,39 mm2. F : Prolapsus intra-artériel de matériel athérothrombotique chez un patient stenté en phase aiguë d’infarctus (flèches). Il n’est pas possible de visualiser les mailles enchâssées dans le thrombus et donc de vérifier leur bonne apposition. G : Complication d’une angioplastie : dissection artérielle (flèche) immédiatement en aval d’un stent (mailles visibles).
Figure 10. Imagerie des bifurcations. A et A’ : Imagerie d’une bifurcation IVA-diag avant et après kissing. Notez l’existence de mailles dans l’ostium de la diagonale (A), réouvertes après le kissing (B) au prix du déplacement d’une maille initialement bien apposée (flèche). B et B’ : Contrôle à 6 mois d’une bifurcation IVA-diagonale traitée par un simultaneous kissing stent. À gauche, la fibre OCT est dans l’IVA et à droite dans la diagonale. Les mailles pariétales des 2 stents sont finement recouvertes (stent au sirolimus) alors que le recouvrement des mailles réalisant la néocarène est hétérogène. C : Coupe axiale OCT en amont d’une bifurcation IVA traitée par technique de rush stenting. Il existe 3 couches de mailles visibles sur la moitié supérieure de la coupe. D : Crush involontaire. Lors d’un kissing au ballon, guide et ballon sont passés à l’extérieur du stent. Après inflation, celui-ci est complètement refoulé sur la droite (2 couches de mailles).
Figure 11. Imagerie des stents à 6 mois de leur implantation. Nous résumons ici les différents résultats possibles : A, B et C. Résultats jugés optimaux. D, E. et F. Résultats jugés imparfaits. G et G’. Résultats nécessitant une réintervention. A et B : Endothélialisation complète, régulière, homogène et non sténosante. C : Endothélialisation complète mais irrégulière avec une disparité de recouvrement des mailles, les mesures allant de 0,04 mm à 0,28 mm. D : Stent actif incomplètement endothélialisé. La couverture des mailles est fine, entraînant dans le quadrant inférieur gauche un aspect crénelé. E : Malapposition localisée des mailles de l’endoprothèse dans le quadrant inférieur gauche. Ces mailles, à distance de la paroi, sont partiellement recouvertes sans que l’on puisse affirmer l’origine du recouvrement. F : Malapposition tardive intéressant la moitié supérieure de l’endoprothèse en coupe axiale avec remodelage positif. L’aspect angiographique pseudo-anévrysmal n’était pas présent en poststenting immédiat. G et G’ : Image de resténose à 6 mois. La surface de la lumière résiduelle est seulement de 11 % de sa surface initiale. Resténose focale visible également en long view.
Conclusion
L’OCT n’est désormais plus une technique réservée à des protocoles de recherche mais peut être une aide au diagnostic et à la thérapeutique dans notre pratique du cathétérisme interventionnel.
Son impact clinique reste à prouver, mais son apport dans la compréhension de la maladie coronaire et de ses traitements est indéniable.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :








