Cardiologie interventionnelle
Publié le 01 mai 2012Lecture 11 min

Le 4e Forum TAVI CoreValve™ illustre les innovations dont a bénéficié le remplacement valvulaire transaortique (TAVI) et le rapide essor de cette technique. Dans le monde, déjà plus de 26 000 patients ont été implantés avec une valve percutanée CoreValve. Les indications se diversifient, de nouvelles voies d’abord sont expérimentées, de nouvelles générations de prothèses seront bientôt disponibles. Si les limites de la technique d’implantation sont sans cesse repoussées, il restera néanmoins des progrès à réaliser dans la prévention des complications thrombotiques.
Rétrospective sur les bicuspidies
D’après D. Himbert, Paris
Les bicuspidies sont encore considérées comme une contre-indication au TAVI (confirmée par la HAS), car exclues des études et des registres. Compte tenu de leur anatomie particulière, le TAVI comporte, en effet, des risques : mauvais déploiement de la prothèse, distorsion des feuillets, fuite intra- et/ou périprothétique, durabilité limitée. L’expérience clinique est limitée, mais la faisabilité de l’implantation a été démontrée.
Plusieurs caractéristiques de la prothèse CoreValve militent en faveur de son adéquation avec les bicuspidies : anneau large permettant de couvrir sans contrainte l’anneau valvulaire natif irrégulier, ancrage sûr, position supra-annulaire de l’appareil valvulaire de la prothèse, peu impacté par l’ellipticité de l’anneau. L’objectif ici est de positionner la prothèse le plus haut possible, après une prédilatation prudente.
Dans l’expérience de l’hôpital Bichat, sur 316 TAVI consécutifs de janvier 2009 à janvier 2012, 15 concernent des bicuspidies documentées. Une prothèse a été implantée par voie transfémorale (n = 14) ou sous-clavière (n = 1), avec succès chez 14 patients (1 échec au début de la technique). Cette expérience confirme la faisabilité d’implantation de la CoreValve dans les bicuspidies par voie transartérielle, avec une amélioration fonctionnelle immédiate (gradient moyen 11 ± 4 mmHg), peu de fuites (13 ≤ 1+ et 1 de grade 2+), pas d’empiètement sur la mitrale et un indice d’ellipticité de la prothèse de 0,7 à l’anneau valvulaire natif et 0,8 au niveau des feuillets prothétiques. À moyen terme (8 ± 7 mois), il n’y a ni détérioration ni dysfonction prothétique. Ces résultats prometteurs devront être confirmés sur de plus larges effectifs et un suivi prolongé.
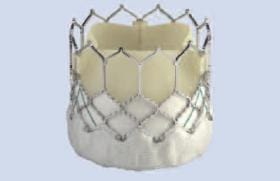
CoreValve 31 mm : retour d’expérience
D’après D. Tché-Tché (Toulouse)
Cette expérience débutante porte sur 5 à 10 cas dans la moitié des centres, telle que rapportée en décembre 2011 à la dernière réunion des proctors. En France, 27 centres ont utilisé la CoreValve 31 mm chez 190 patients (27 implantations à la Clinique Pasteur, Toulouse jusqu’en mars 2012).
La CoreValve 31 mm possède une structure similaire à celle de la 29 mm et se différencie par une hauteur un peu moins élevée et une partie basse (zone d’ancrage et d’étanchéité intra-annulaire) plus évasée sur les 5 derniers millimètres pour atteindre un diamètre de 31 mm. L’implantation requiert un positionnement précis et haut pour ne pas exposer le patient à un risque de fuite paraprothétique. Elle convient à des anneaux natifs de 26 à 31 mm.
La prédilatation se fait avec un ballon de 25 mm sous-dimensionné, permettant de bénéficier d’une aide à l’ancrage et à l’étanchéité des sigmoïdes aortiques autour de la prothèse L’objectif est de positionner la prothèse à moins de 4 mm sous le plan de l’anneau. La position du guide Stiff, s’appuyant sur une bonne partie du ventricule gauche, est un élément majeur du déploiement, en poussant la prothèse vers le haut pour éviter une implantation trop basse. Le guide Amplatz Super Stiff™ (Boston Scientific) est recommandé. Il important que l’implanteur confectionne une courbure distale harmonieuse qui garantit une bonne stabilité dans le ventricule gauche afin de verrouiller très haut la prothèse. Le déroulement d’une pose de valve 31 mm est légèrement plus long que pour les tailles 26 ou 29 mm.
Il est possible de post-dilater cette prothèse avec des ballons courts et de diamètre maximum 28mm pour éviter tout risque de rupture. La recapture de la prothèse, si elle est trop basse, est délicate mais faisable au moyen de l’introducteur 18 Fr COOK.
Les voies transaortique et sous-clavière peuvent faciliter l’implantation dans les anatomies complexes (anneau vertical, aorte horizontale, bicuspidies).
Quel traitement antithrombotique post-TAVI ?
D’après J.-Ph. Collet (Paris)
La question se justifie par l’incidence élevée des AVC post-TAVI, évaluée selon une récente métaanalyse ayant inclus plus de 10 000 patients à 1,5 % en per-procédure, 3,3 % à J30 (2,9 % AVC majeurs) et 5,2 % à 1 an, et leur impact sur la mortalité (Eggebrecht H et al. Eurointervention 2012 Mar 6). Ce type d’intervention est corrélé à une incidence élevée de fibrillations atriales (FA) de novo, transitoires mais responsables d’une augmentation des AVC cardio-emboliques (x 4,5) et de la mortalité.
Les recommandations (Chest 2008) préconisent de prescrire de l’aspirine ou un anticoagulant chez les sujets à risque d’AVC. Les dernières recommandations de l’ESC (www.escardio.org/guidelines), consacrent les anticoagulants, laissant peu de place à l’aspirine en prévention des complications emboliques de la FA chez les sujets à risque. Parmi les nouveaux anticoagulants, l’apixaban a largement démontré sa supériorité sur l’aspirine en prévention primaire (Diener HC et al. Lancet Neurol 2012 ; 11 : 225-31). Le double traitement antiplaquettaire n’est pas significativement supérieur sur la mortalité et les événements cardiovasculaires majeurs à J30.
Le choix du traitement antiplaquettaire ou anticoagulant doit aussi tenir compte des particularités des sujets âgés qui sont la population cible des TAVI (résistance aux tiénopyridines liée à une réactivité plaquettaire élevée et à la baisse de la fonction rénale), ce qui laisse peu de place à la bithérapie. Mais le traitement anticoagulant, plus efficace que l’aspirine, majore le risque de saignement. Les nouveaux anticoagulants, dont le profil de sécurité est amélioré, pourraient avoir leur place dans cette indication.
En pratique, la moitié des patients implantés par TAVI sont éligibles au traitement anticoagulant (lequel ?), un quart à la double antiagrégation plaquettaire et un quart à une association aspirine + anticoagulant. En pratique la majorité reçoit une bithérapie de courte durée puis de l’aspirine seule.
Global Valve-in-Valve Registry
D’après J.-C. Laborde (Londres)
La procédure valve-in-valve (VIV) consistant à pallier par TAVI la défaillance d’une bioprothèse aortique, dont la dégénérescence est habituelle dans les 10-15 ans suivant son implantation chirurgicale, est probablement la technique la plus simple. Il est théoriquement inutile de pré-dilater et post-dilater ; le risque de trouble conductif est très faible, de même que celui de fuites paravalvulaires. Un registre VIV a été mis en place par D. Dvir, qui regroupait en novembre 2011 195 cas (120 par CoreValve et 71 par Edwards-Sapien) avec 75,4 % de valves stentées et 24,6 % non stentées ; les diamètres nominaux étaient dans 41 % des cas de 23 mm, 24 % de 25 mm et 24 % de 21 mm. Le plus souvent ce sont des petites valves qui ont été utilisées. De façon surprenante, une pré-dilatation pourtant considérée comme dangereuse (risque d’emboles), a souvent été pratiquée. Les taux de réussite d’implantation sont non significativement différents selon le type de valve implantée (> 90 %), de même que le taux d’AVC. Quelle que soit la valve, un retrait a été nécessaire dans 10 % des cas et une post-dilatation a été nécessaire, essentiellement avec la CoreValve (16,7 % vs 5,6 %). Une occlusion coronaire est survenue dans 3,3 et 4,2 % des cas avec la CoreValve et l’Edwards-Sapien (NS), en traitement d’une Mitroflow et d’une Sorin. La mortalité à J30 est de 7,5 et 12,7 % (NS), principalement d’origine cardiovasculaire ; le besoin de pacemaker, de 9,3 et 5,8 %. Pour les diamètres internes de bioprothèse < 20 mm, les gradients post-procédure restent élevés, d’où l’avantage d’une position supra-annulaire de l’appareil valvulaire de la prothèse CoreValve. À 1 an, il y a environ 85 % de survie dans les 2 groupes et le bénéfice hémodynamique est incontestable, bien qu’insuffisant.
Si la technique de VIV a démontré sa faisabilité et son efficacité, des progrès techniques sont néanmoins attendus.
Gestion des fuites para-prothétiques
D’après N. Dumonteil (Toulouse)
Dans la grande majorité des cas, les fuites observées sont péri-prothétiques. Seules les fuites de grade ≥ 2+ sont considérées, en raison de leur impact pronostique sur la mortalité hospitalière, opératoire et postopératoire ; leur fréquence dans les registres européens est de 15 à 18 %. L’évaluation d’une fuite peut être réalisée par échographie (transœsophagienne si l’intervention a été réalisée sous anesthésie générale, ou trans-thoracique sous anesthésie locale), mais les critères échographiques ne sont pas vraiment adaptés à l’évaluation quantitative objective des fuites post-procédure. L’évaluation angiographique, utilisant la classification de Sellers en 4 stades est également peu fiable. L’évaluation hémodynamique fournit une évaluation plus reproductible au moyen de critères simples (PAo différentielle, PTDVG), mais il manque une définition consensuelle du seuil d’intervention. Une équipe allemande a toutefois défini, sur une série de 167 patients évalués par angiographie et hémodynamique, un seuil de 18 mmHg (D P DPA-LVEDP) au-delà duquel la mortalité à court, moyen et long terme est nettement augmentée. Les mécanismes de la fuite sont une prothèse sous-dimensionnée (discongruence, souvent en cas d’anneau large, d’où l’intérêt de la mesure précise de la racine aortique par scanner préopératoire), une mal-apposition nécessitant une post-dilatation, une implantation trop haute ou trop basse (fuite en amont), contraignant à l’implantation d’une seconde prothèse dans la première.
Bilan gériatrique et coopération gériatre/Heart Team
D’après O. Hanon (Paris), J. Belmin (Paris)
Le gériatre peut contribuer à sélectionner les patients qui ne tireront pas bénéfice du TAVI en identifiant les sujets fragiles, à risque de dépendance, d’échec thérapeutique, de décompensation postopératoire, au moyen d’une évaluation gériatrique standardisée (EGS) qui permet de déterminer l’existence de comorbidités, de troubles cognitifs et de l’humeur, d’une dénutrition, d’une sarcopénie.
Une étude coopérative observationnelle, financée par le Programme hospitalier de recherche clinique, EVA-G-TAVI, est mise en place afin d’évaluer si certains marqueurs de fragilité pourraient représenter des facteurs de moins bon pronostic fonctionnel et/ou de dégradation de la qualité de vie après TAVI. Le critère de jugement principal est l’index de Barthel qui évalue l’autonomie fonctionnelle.
Le sizing en direct
D’après O. Bar (Tours), G. Mouillet (Créteil)
Le facteur clé du succès de la procédure TAVI est la qualité du sizing effectué avec la bonne adéquation du diamètre de la prothèse au diamètre de l’anneau et à l’anatomie de la racine aortique. Le scanner (fenêtré) est à cet égard plus précis que l’échographie, grâce à son excellente résolution en contraste. Il est opérateur-indépendant, à risque radique faible après 80 ans et nécessite un faible volume de contraste (< 80 cm3). Toutes les équipes devraient disposer d’une console de reconstruction pour réaliser au mieux le sizing par scanner.
TAVI par voie alternative
D’après T. Modine (Lille), B. Chevalier (Massy), A. Farge (Massy) et B. Marcheix (Toulouse)
Des voies d’abord alternatives à la voie fémorale sont développées pour faciliter l’implantation des prothèses : sous-clavière, transaortique, carotidienne. La voie sous-clavière, de préférence gauche, nécessite une courbe d’apprentissage plus importante.
Les résultats des TAVI par voie sous-clavière en France (environ 6 % des TAVI toutes valves confondues) devraient prochainement être publiés dans le registre France 2.
Dernière voie d’abord alternative, la voie directe aortique, inaugurée en 2008, va sans doute connaître un nouvel essor dans les mois à venir. Elle a d’ailleurs été utilisée dans 11 % des cas de patients implantés en France en février 2012 dans le registre France 2. Les intérêts potentiels de cette voie d’abord sont multiples et la rendent très séduisante. L’abord direct aortique évite les complications vasculaires en particulier ilio-fémorales, et également la « traversée » de l’aorte horizontale, ce qui pourrait diminuer les complications neurologiques. Elle n’engendre aucun dommage ventriculaire gauche à la différence de l’abord apical et semble beaucoup mieux tolérée au plan respiratoire. Le taux de mortalité rapporté dans la première série européenne est d’ailleurs très encourageant puisque de 7% chez des patients porteurs de multiples comorbidités.
En pratique, cet abord est possible soit par manubriotomie (ministernotomie), soit par minithoracotomie droite. La voie la plus utilisée en France est la manubriotomie, voie techniquement simple de réalisation et peu douloureuse.
Dans la sélection des patients, trois paramètres supplémentaires sont à prendre en compte : une distance ≥ 6 mm entre le point de ponction dans l’aorte ascendante et le plan de l’anneau aortique, la possibilité de trouver un point de ponction autorisant un trajet perpendiculaire au plan de l’anneau et une paroi aortique de bonne qualité non calcifiée au niveau du point de ponction.
Cette voie d’abord reste en cours d’évaluation. Tous les avantages théoriques aujourd’hui avancés doivent être démontrés par de plus larges études.
La voie carotidienne (encore très exploratoire et réservée aux équipes ayant les compétences et une expérience de cet accès) plus rapide que la sous-clavière, donne un accès très direct à l’anneau aortique ; elle nécessite un screening soigneux des facteurs de risques et un IRM préopératoire pour l’analyse du polygone de Willis, ce qui peut aussi être fait par Doppler transcrânien, en examinant bien les artères vertébrales. Un diamètre minimal de la carotide de 7 mm est recommandé. La dilatation vasculaire est réalisée progressivement avec des cathéters de 12, 14 et 16 F et l’implantation avec un introducteur de 18 F.
Recommandations des proctors
D’après D. Himbert (Paris)
Le forum s’est terminé par un résumé de la réunion des proctors européens qui s’est tenue à Barcelone le 16 décembre 2011. Son but était de dégager un consensus sur les meilleures pratiques concernant certains points spécifiques de l’utilisation de la CoreValve, afin de faciliter et d’encadrer au mieux l’éducation des équipes et le développement de ce traitement. Les principales questions abordées concernaient la mesure de l’anneau aortique, l’évaluation et le traitement des fuites paraprothétiques, l’indication éventuelle représentée par l’insuffisance aortique pure, les spécificités d’utilisation de la CoreValve 31mm, l’utilisation de la voie sous-clavière gauche chez les patients ayant un greffon mammaire interne gauche perméable, et les premiers résultats de la voie transaortique directe.
Programme clinique et prochaines innovations
D’après X. Bertrand (Medtronic)
Le TAVI se développe rapidement, de manière contrôlée grâce aux innovations et aux programmes cliniques avec, pour la seule CoreValve, près de 10 000 patients inclus ou à inclure. La recherche Medtronic s’oriente sur 3 axes : les prothèses, les cathéters et la procédure. La gamme de prothèses continue de s’élargir, et prochainement toutes bénéficieront d’un traitement anti-calcification ; la nouvelle plateforme CoreValve sera dotée d’un nouveau design ; à plus long terme une valve mitrale sera disponible. Des systèmes de largage dédiés, plus ergonomiques et permettant la recapture et le repositionnement de la prothèse sont en cours de développement. L’objectif est ainsi d’offrir des solutions spécifiques pour les différents accès.
4e Forum TAVI CoreValve™, 16 mars 2012
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :