Rythmologie et rythmo interventionnelle
Publié le 30 mai 2006Lecture 6 min
QT long acquis : que faire ?
C. BARNAY, Centre Hospitalier du Pays d'Aix, Aix-en-Provence

- Dès 1920, on avait décrit les malaises parfois syncopaux observés après la prise de quinidine, utilisée à l'époque pour réduire les accès de fibrillation auriculaire. Cependant, ce n'est qu'en 1966 que le trouble du rythme ventriculaire responsable des syncopes fut décrit par Dessertenne sous le nom de torsades de pointes.
- Entre temps, les syndromes du QT long congénital, rapportés en 1957 pour le syndrome de Jervell et Lange-Nielsen comportant une surdité, et en 1963 pour le syndrome de Romano-Ward furent découverts, associant un allongement de l'intervalle QT et des syncopes, dont le mécanisme fut identifié par la suite à des torsades de pointes. Des travaux d'électrophysiologie cellulaire, puis, à partir de 1994, des travaux génétiques relatifs à ces syndromes ont permis de comprendre le mécanisme de l'allongement du QT et des torsades.
- Au cours des 10 dernières années, une dizaine de médicaments ont été retirés du marché en raison du risque de torsades de pointes. En outre, la liste des produits susceptibles de causer un allongement de l'intervalle QT et potentiellement responsables de torsades de pointes s'allonge sans cesse.
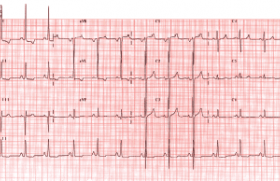
Le diagnostic de torsades de pointes sur l'électrocardiogramme standard est généralement facile lorsque s'associent un allongement de l'intervalle QT > 500 ms, des extrasystoles R/T à couplage long avec des pauses postextrasystoliques qui peuvent favoriser un rythme bigéminé, lequel a alors la signification d'un syndrome de menace de torsades de pointes. Celles-ci ont un aspect caractéristique, recouvrant bien la dénomination imagée proposée par Dessertenne, avec des complexes QRS dont l'amplitude et la largeur varient progressivement, de telle sorte que leur axe semble s'enrouler autour de la ligne isoélectrique (figure 1). Ce trouble, qui est différent de la fibrillation ventriculaire, peut cependant dégénérer en fibrillation. La plupart du temps, il est spontanément résolutif, pouvant se reproduire par accès de durée plus ou moins prolongée.
Figure 1. Électrocardiogramme de torsades de pointes.
Traitement d’urgence
Le traitement d'urgence de l'accès de torsades de pointes, en dehors de la fibrillation ventriculaire qui requiert une cardioversion électrique d'urgence, repose sur l'accélération de la fréquence cardiaque :
• soit par entraînement électrosystolique transveineux, à une fréquence de 100 à 140 par minute,
• soit par l'administration veineuse d’isoprotérénol, seulement dans le cas de bradycardie ou de pauses et lorsque la stimulation est temporairement impossible.
Par ailleurs, l'administration intraveineuse de magnésium agit en réduisant l'amplitude des postpotentiels précoces responsables de l'arythmie, par blocage du courant entrant calcique. On administre 2 grammes de sulfate de magnésium IV (20 cm3 de solution à 10 %) en une à deux minutes, manœuvre que l'on peut répéter deux fois à des intervalles de 5 à 15 minutes. On associe, le cas échéant, une supplémentation en potassium de façon à atteindre une kaliémie de 4 à 5 mmol/l. La lidocaïne est également efficace dans 50 % des cas. Enfin, le retrait de l'agent torsadogène, lorsqu'il est identifié, est bien entendu impératif.
Facteurs de risque
Produits à risque
- On peut trouver sur Internet des sites qui répertorient les drogues potentiellement dangereuses au titre de l'allongement de l'intervalle QT. Ainsi, l’Arizona Center for Education and Research on Therapeutics répertorie 23 drogues à risque, 29 à risque possible, 73 produits déconseillés aux porteurs de QT long congénital et 19 médicaments à faible risque aux doses habituelles, malgré des données fragmentaires ou des cas isolés. Une liste de produits à risque de torsades de pointes est donnée dans l’encadré 1.
Encadré 1. Médicaments les plus couramment incriminés à l'origine de torsades de pointes.
Disopyramide
Dofétilide
Ibutilide
Procaïnamide
Quinidine
Sotalol
Bepridil
Amiodarone
Trioxyde d'arsenic
Cisapride
Antagoniste calcique : lidoflazine
Anti-infectieux : clarithromycine, érythromycine, halofantrine, pentaminidine, sparfloxacine
Anti-émétiques : dompéridone, dropéroidol
Antipychotiques : chlorpromazine, halopéridol, mésoridazine, thioridazine, pimozide
Méthadone.
Pathologies
Un certain nombre de conditions peuvent favoriser la survenue d’un allongement de l'intervalle QT et de torsades de pointes. On peut citer, outre la bradycardie par dysfonctionnement sinusal ou bloc auriculo-ventriculaire :
• les anomalies électrolytiques (hypokaliémie, hypocalcémie, hypomagnésémie),
• diverses atteintes myocardiques (ischémie, myocardite, insuffisance cardiaque congestive),
• diverses atteintes neurologiques (accident vasculaire cérébral, hémorragie sous-arachnoïdienne),
• et des troubles nutritionnels graves (anorexie mentale, ca-chexie, maladie cœliaque).
Le sexe féminin semble enfin plus exposé que le sexe masculin aux accidents d'allongement de QT et de torsades de pointes (encadré 2).
Encadré 2 - Facteurs de risque de torsades de pointe induites par des médicaments.
Sexe féminin
Hypokaliémie
Bradycardie
Conversion récente de FA
Insuffisance cardiaque congestive
Digitalisation
Doses élevées de ces médicaments
Injection intraveineuse de ces médicaments
QT long
Syndrome infraclinique de QT long
Polymorphismes des canaux ioniques
Hypomagnésémie sévère
Facteurs métaboliques
D'autres facteurs, d'ordre métabolique, interviennent dans la genèse de l'allongement de QT. Ainsi, certains médicaments ayant la propriété et de prolonger l'intervalle QT ont des métabolites actifs. Le cytochrome P450 est impliqué dans la métabolisation de nombre de ces produits. On évalue à 10 % la proportion de métaboliseurs lents parmi les sujets de race européenne. Il existe, en outre, des inducteurs mais aussi des bloqueurs du système CYP3A4 qui peuvent modifier la demi-vie des drogues. On peut donner comme exemple de tels inhibiteurs les macrolides, la cimétitine, le jus de pamplemousse.
Mécanisme des arythmies du QT long acquis
Les drogues qui prolongent l'intervalle QT agissent en bloquant le courant potassique Ikr, qui est un courant sortant repolarisant (rapidly activating delayed rectifier) (figure 2). La prolongation de la durée du potentiel d'action est à l'origine de post-potentiels précoces qui, par un mécanisme d'activité déclenchée, entraînent des extrasystoles et des arythmies réentrantes (figure 3). Les canaux potassiques Ikr sont constitués de deux sous-unités, alpha et bêta (figure 4) exprimées par les gènes HERG et MiRP1. Dans la forme LQT2 de QT long congénital, les mutations diminuent le nombre de canaux HERG fonctionnels. Ainsi, les drogues bloquant les canaux HERG pourraient induire une forme iatrogène de LQT2.
Figure 2. Représentation des différents courants ioniques cardiaques.
Figure 3. Mécanismes des arythmies du QT long : postpotentiels précoces et activité déclenchée.
Figure 4. Schéma du canal potassique Ikr.
Le QT long acquis est-il une maladie congénitale ?
Certaines drogues, comme l’amiodarone, qui prolongent l'intervalle QT, causent rarement des torsades de pointes. Au contraire, d'autres, malgré un allongement minime de QT, peuvent être à l’origine de torsades. En outre, le risque varie d'un patient à un autre pour un QT équivalent. Cette marge, variable selon les cas, a été appelée « réserve de repolarisation ». Ainsi, certains auteurs pensent que les torsades de pointes dues à des médicaments pourraient être liées à des formes frustes de QT long congénital, dans lesquelles le médicament pourrait démasquer une réserve de repolarisation faible. En effet, des mutations silencieuses des gènes responsables du QT long congénital ont été mises en évidence chez des patients asymptomatiques, produisant des anomalies des courants repolarisants insuffisantes pour prolonger l'intervalle QT. Par ailleurs, certaines familles de QT long congénital ont une transmission récessive et une pénétrance faible.
Comment prédire qu'une drogue est susceptible de causer des torsades de pointes ?
Il n'existe pas de relation simple entre torsades de pointes, prolongation de QT et blocage de Ikr. Il est donc difficile de prédire si un médicament particulier va causer des torsades chez un patient particulier ou dans un groupe.
Les antiarythmiques
À une extrémité du spectre, on peut placer les antiarythmiques qui prolongent le QT. L'amiodarone mise à part, ils bloquent le Ikr et prolongent le QT de plus de 50 ms : le risque est assez bien identifié, > 1 %.
La terfénadine
À l'autre extrémité du spectre, se situe la terfénadine, puissant bloqueur de Ikr : chez les sujets normaux, la prolongation moyenne de QT est de 6 ms. En effet, le produit est complètement transformé en un métabolite inactif par CYP3A4 avant d'entrer dans le système circulatoire. Si CYP3A4 est bloqué, saturé ou déprimé par une maladie, la concentration de terfénadine dans le système circulatoire pourra augmenter de façon importante.
Plusieurs millions de patients ont été exposés à la terfénadine dans les années 80, sans cas rapporté de torsades de pointes ; une prolongation de 6 ms de QT ne comporte pas de risque de torsades. Pourtant, cette drogue est éliminée par une voie unique, son activité dépend de facteurs génétiques, de maladies associées, de la prise simultanée d'inhibiteurs ; elle peut être prescrite à des patients ayant une réserve de repolarisation réduite (insuffisance cardiaque, syndrome du QT long congénital infraclinique ; le risque peut être beaucoup plus important chez certains patients.
Risques thérapeutiques et risques industriels
Tout cela pose la question du rapport risque/bénéfice, en particulier pour les médicaments à action préventive. Il existe des risques difficiles à prévenir ou à prédire (facteurs génétiques, maladies associées, interférence de conditions diverses). Il existe des risques graves mais rares, qui peuvent ne pas être identifiés dans les études cliniques précédant la commercialisation parce que ces études ne comportent pas suffisamment de patients : si le risque est de 1/100 000, il n 'apparaîtra pas dans ces études mais seulement lorsque des millions de patients seront traités. Le retrait d'un médicament du marché est une arme à double tranchant qui protège l’ensemble de la population des patients des quelques cas d'accidents qui se seraient produits, mais prive un grand nombre d'entre eux du bénéfice d'une thérapeutique efficace. Enfin, le risque industriel existe pour les fabricants et peut les dissuader de développer de nouvelles drogues si ce risque est trop important.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :