Échocardiographie
Publié le 19 mai 2009Lecture 19 min
Dossier - La valve tricuspide
C. CHAUVEL, E. ABERGEL, M. JIMENEZ, P. DEHANT, Clinique Saint-Augustin, Bordeaux
La valve auriculo-ventriculaire droite est moins bien connue que la valve auriculo-ventriculaire gauche. Pourtant, tout examen échographique se dirige à un moment ou à un autre, le plus souvent en fin d’examen, vers l’orifice tricuspide qui, aussitôt repéré, est rempli par la couleur du Doppler à la recherche du jet de régurgitation tricuspide, sésame de l’évaluation des pressions pulmonaires. Un coup d’œil indispensable aux variations de calibre de la veine cave inférieure et, le cœur gauche ayant été étudié, voici le bilan hémodynamique bouclé. Si, en pratique quotidienne, ce « passage rapide » sur la tricuspide est suffisant, l’échographiste est très vite mal à l’aise lorsque la petite « flammèche » recherchée se trouve remplacée par une inondation systolique colorée. La mauvaise tolérance à long terme de ces régurgitations tricuspides importantes justifie qu’une étude rigoureuse de cette valve méconnue soit réalisée. L’analyse des plans de coupe échographiques nécessite, pour être performante, une connaissance précise de l’anatomie de la valve et de ses rapports avec les autres structures.
Rappel anatomique
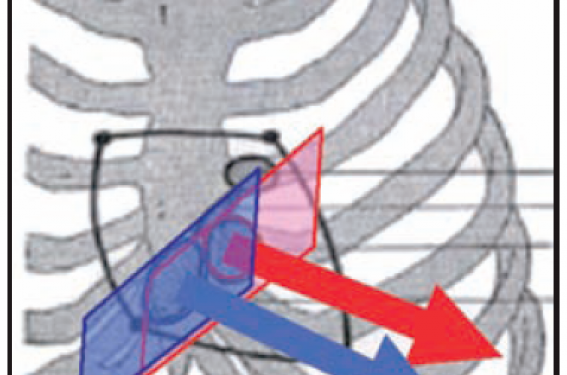
Les deux orifices auriculo-ventriculaires sont contigus à l’orifice aortique alors que l’orifice pulmonaire n’est en relation qu’avec l’orifice aortique. Les deux anneaux mitral et tricuspide et l’anneau aortique sont reliés au niveau du trigone fibreux droit. Les deux orifices mitral et tricuspide sont situés dans deux plans presque parallèles et regardent dans la même direction, vers la pointe du cœur (figure 1). À gauche, les orifices aortique et mitral sont contenus dans deux plans à environ 120 °, comme sur les pages d’un livre ouvert (figure 2), avec un orifice aortique regardant en bas et à gauche vers la pointe du VG. À droite, en revanche, le livre devient un dossier à large dos, ce « dos » correspondant à l’infundibulum pulmonaire qui sépare l’anneau tricuspide de l’anneau pulmonaire (figure 3), ce dernier regardant en bas et légèrement à droite vers l’appendice xiphoïde. Ce large « dos » correspond en fait à l’emplacement de l’anneau aortique. Cela explique l’impression, en fait la réalité, d’enroulement des cavités droites autour de l’orifice aortique (bien imagée en coupe petit axe parasternale).
Figure 1. Orientation des anneaux auriculo-ventriculaires.
Figure 2. Plans des anneaux aortique et mitral.
Figure 3. Plans des anneaux tricuspide et pulmonaire.
La valve tricuspide est vue par l’avant sur la figure 4, toute la paroi antérieure du ventricule droit ayant été réséquée. On reconnaît la valve antérieure, la plus développée, répondant à la paroi antérieure réséquée, la valve postérieure, posée sur la face diaphragmatique du cœur et la valve septale, verticale. Comme son nom l’indique, la valve tricuspide est censée être composée de trois feuillets. En fait, un intéressant travail de Wafae portant sur 50 cœurs montre que, dans 72 % des cas, on dénombre plus (le plus souvent) ou moins de trois feuillets, avec quatre feuillets dans plus de la moitié des cas. Ce quatrième feuillet (plus ou moins bien individualisé) est alors antérolatéral, entre les feuillets antérieur et postérieur.
Figure 4. Vue de la tricuspide après résection de la paroi antérieure du VD (Document A. Netter).
L’appareil sous valvulaire tricuspide est complexe. Un pilier antérieur, issu de la paroi antérieure, donne la plupart des cordages de la valve antérieure et quelques cordages pour la valve postérieure. Un ou deux piliers inférieurs émergent de la paroi inférieure et donnent des cordages pour la valve inférieure et la partie basse de la valve septale. Le reste de la valve septale est retenu par des cordages qui s’insèrent directement sur le septum et sur de petites colonnes, dont la plus habituelle est le muscle du cône artériel, assez haut situé, à la partie inférieure de l’infundibulum pulmonaire.
L’anneau tricuspide est un peu plus grand (en circonférence) que l’anneau mitral.
Une image d’échographie 3D de la base du cœur aide à se représenter les lignes de coupe de l’appareil valvulaire tricuspide obtenues à partir des incidences classiques (figure 5) :
La coupe apicale 4 cavités va passer par les valves septale et antérieure (figure 6).
La coupe parasternale petit axe va entrer dans l’anneau tricuspide au niveau de la partie haute de la valve septale à proximité de la commissure avec la valve antérieure, puis couper la valve postérieure (figure 7). Ceci explique que, lorsque cette coupe passe par la commissure, on puisse avoir l’impression que la valve septale disparaît en diastole. Ceci explique aussi les petits jets de fuite tricuspide commissurale au contact immédiat de l’anneau aortique.
La coupe parasternale grand axe des cavités droites va passer à distance du cœur gauche et de la valve septale, en coupant les valves antérieure et postérieure (figure 8).
La coupe 4 cavités peut être obtenue également par voie sous-costale explorant pratiquement les mêmes zones que par voie apicale (figure 9).
La coupe sous-costale petit axe de la base est intéressante car elle va « entrer » dans l’anneau au niveau de la commissure entre valves postérieure et antérieure et en sortir au niveau de la commissure entre valves antérieure et septale mais elle peut être difficile à réaliser chez certains patients (figure 10).
Figure 5. Représentation des différents plans de coupe échographiques permettant d’explorer la valve tricuspide, en projection sur une image d’échographie tridimensionnelle des valves mitrale et tricuspide vues par les ventricules.
Figure 6. Incidence apicale des 4 cavités en diastole permettant de visualiser les feuillets antérieur (A) et septal (S) de la valve tricuspide.
Figure 7. Incidence parasternale petit axe en diastole permettant de visualiser les feuillets antérieur (P) et septal (S) de la valve tricuspide.
Figure 8. Incidence parasternale grand axe des cavités droites en diastole permettant de visualiser les feuillets antérieur (A) et postérieur (P) de la valve tricuspide.
Figure 9. Incidence sous-costale 4 cavités visualisant pratiquement les même feuillets que par voie apicale.
Figure 10. Incidence sous-costale petit axe passant près des deux commissures de la valve antérieure. On visualise ici en diastole une partie des valves antérieure et postérieure.
Nous disposons ainsi de 4 coupes (figure 5) explorant les différents segments de la valve et permettant de localiser les éventuelles lésions :
– 4 cavités,
– 2 cavités passant par les cavités droites,
– petit axe parasternale,
– petit axe sous-costale.
L’anneau tricuspide a fait l’objet de travaux récents. Deux études utilisant l’échographie tridimensionnelle ont bien décrit la forme de l’anneau tricuspide normal (Ton-Nu et Anwar). Comme l’anneau mitral, il n’est pas plan et, comme lui, il présente deux points « hauts » (plus près de l’apex), situés en regard de la valve aortique, à proximité de la commissure entre valves septale et antérieure, pour le premier, et diamétralement opposé pour le second, à proximité de la commissure entre valves antérieure et postérieure. Les deux points « bas » sont situés de part et d’autre, le point interne situé en regard d’un point « bas » de l’anneau mitral.
Ces travaux sont concordants pour démontrer qu’en cas de fuite tricuspide, cet anneau se dilate, devient circulaire et s’aplatit proportionnellement au degré de l’insuffisance tricuspide (comme l’anneau mitral).
Un travail chirurgical (Dreyfus) montre également que la dilatation se fait par déformation de la partie libre de l’anneau et donc par augmentation de la distance entre les commissures valves septale/valve antérieure et valve antérieure/valve postérieure.
Analyse échocardiographique
Peut-on et où mesurer l’anneau tricuspide ?
La mesure la plus habituelle est réalisée en diastole en coupe apicale des 4 cavités (figure 11). Plus rarement, on mesure en coupe parasternale petit axe. Encore une fois, les travaux récents en 3D (Anwar) nous apportent des données intéressantes : le plus grand diamètre de l’anneau tricuspide en imagerie 3D est toujours supérieur à l’un quelconque de ces deux diamètres mesurés en 2D en pratique. L’analyse des données 3D montre que le plus grand diamètre est celui qui joint les commissures valve antérieure/valve septale et valve antérieure/valve postérieure. Ce diamètre est celui qui est inclus dans la coupe sous-costale petit axe. Ceci se vérifie au quotidien et s’explique si l’on reporte les différents plans de coupe sur une vue en échographie 3D, illustrant la zone de déformation et de dilatation annulaire (figure 12).
Figure 11. Mesure de l’anneau tricuspide en incidence apicale des 4 cavités en diastole.
Figure 12. Représentation schématique de la dilatation de l’anneau tricuspide (ligne pointillée) par rapport aux plans de coupe échographiques. On voit qu’en théorie, c’est dans l’incidence sous-costale petit axe que l’on est le mieux placé pour évaluer cette dilatation.
Nous avons pris l’habitude, pour l’anneau mitral, d’utiliser le rapport entre diamètre antéro-postérieur (coupes parasternale grand axe ou apicale 3 cavités) de l’anneau et longueur de la valve mitrale antérieure mesurée en diastole, un rapport supérieur à 1,3 signant une dilatation annulaire. Qu’en est-t-il de l’anneau tricuspide ? Aucune indexation de ce type n’est préconisée pour l’anneau tricuspide. Un chiffre (seuil de dilatation) en valeur absolue est proposé par Dreyfus en peropératoire : 70 mm ! Cela nous paraît énorme, mais il s’agit d’une mesure anatomique sur cœur arrêté, en déformant l’anneau par l’introduction d’une réglette.
Un seul travail donne un chiffre seuil de 40 mm en valeur absolue et indexé de 21 mm/m2 (Colombo), chiffre repris dans les recommandations européennes de 2007 (Vahanian).
Cette mesure est effectuée en 4 cavités, qui n’est pas, nous l’avons vu, la coupe idéale pour apprécier la dilatation annulaire. Il reste donc un travail à réaliser pour être plus efficace dans la détermination d’une dilatation de l’anneau tricuspide.
Étiologies et physiopathologie
Étiologies et mécanismes des insuffisances tricuspides
Environ 75 % des fuites tricuspides importantes sont fonctionnelles, les autres sont organiques.
Les fuites organiques
Elles ont pour mécanisme soit une restriction, soit un excès du jeu valvulaire (ce jeu doit donc être analysé pour chacun des 3 feuillets). Il s’y associe souvent une composante fonctionnelle par dilatation annulaire.
L’atteinte carcinoïde est caractérisée par un épaississement des feuillets, rigides et rétractés, avec défaut de coaptation central, sans dilatation annulaire marquée (figures 13).
L’atteinte rhumatismale, devenue rare dans nos régions, associe un épaississement et une rétraction des valves et des cordages, avec un degré plus ou moins marqué de fusion commissurale, responsable d’une maladie tricuspide (associant à des degrés divers sténose et insuffisance valvulaire) (figure 14)
La maladie d’Ebstein est une anomalie du développement de tout l’appareil tricuspide. Elle se définit par un déplacement de l’orifice tricuspide vers la pointe du ventricule droit. Cette cardiopathie congénitale est rare (1 pour 100 000 naissances), son diagnostic peut être fait de la période fœtale à l’âge adulte. Le spectre clinique et anatomique est très variable d’un patient à l’autre. L’étude anatomique de cette malformation est principalement échographique, celle-ci va permettre de définir le degré de l’atteinte des trois feuillets et la dilatation de l’anneau tricuspide :
• le feuillet septal est déplacé vers la pointe du VD avec un accolement au septum (par des attaches septales courtes assez fréquemment), le mouvement valvulaire est faible ou nul, entraînant un mécanisme de restriction valvulaire (figure 15) ; le décalage mitro-tricuspidien est sensibilisé par le Doppler couleur avec mesure de la distance entre l’émergence de la fuite tricuspide et la valve mitrale antérieure en incidence des 4 cavités (figure 16) ;
• le feuillet antérieur est implanté normalement au niveau de l’anneau tricuspide, mais sa partie distale peut être très anormale avec une restriction : insertion anormale sur les piliers tricuspidiens, voire insertion directe sur le muscle du VD entraînant alors un déplacement vers le haut et vers l’avant sous l’infundibulum pulmonaire réduisant de façon très importante la taille fonctionnelle du VD (forme sévère de la maladie).
C’est l’atteinte de ce feuillet qui conditionne la gravité de l’atteinte fonctionnelle de la valve tricuspide ;
• le feuillet postérieur est touché de façon variable, parfois très dysplasique. La chambre atrialisée ou intermédiaire, comprise entre l’anneau tricuspide anatomique et l’implantation basse de la valve septale, a une paroi souvent mince qui peut être hypokinétique, akinétique, voire dyskinétique. Le VD est souvent de taille réduite mais variable selon l’importance du décalage mitro-tricuspidien et l’anatomie de la valve antérieure. L’anomalie d’Ebstein est associée dans 40 à 50 % des cas à une CIA ou un FOP (shunt souvent droit-gauche entraînant une cyanose).
Le prolapsus valvulaire dystrophique s’accompagne rarement (au contraire de la valve mitrale) de rupture de cordages et il est très rarement responsable d’une fuite importante (figure 17).
L’endocardite infectieuse peut s’accompagner de lésions valvulaires plus ou moins sévères (figure 18). Lorsqu’il existe une destruction tissulaire étendue, la fuite tricuspide peut être importante.
L’étiologie traumatique est rare. On observe généralement un capotage d’une partie de l’appareil valvulaire tricuspide (figure 19). Ceci peut être découvert plusieurs décennies après le traumatisme thoracique, soit de façon fortuite, soit parce que la fuite entraîne une symptomatologie fonctionnelle.
Figure 13. Valvulopathie tricuspide carcinoïde. On note un épaississement des feuillets avec rigidité. En Doppler couleur, la fuite est importante avec un jet très large.
Figure 14. Valvulopathie tricuspide d’origine rhumatismale ; on note une limitation du mouvement des feuillets en diastole (A) liée à la fusion commissurale ainsi d’un défaut de coaptation en systole (B) responsable d’une régurgitation. L’aspect épaissi du bord libre avec rétraction du tissu est typique de cette étiologie.
Figure 15. Maladie d’Ebstein vue en incidence apicale des 4 cavités. On note un décalage très marqué de l’insertion de la valve septale de la tricuspide (flèche).
Figure 16. Même patient que figure 15 avec la mesure du décalage de la valve septale (ici 4,2 cm) et visualisation de la fuite tricuspide en Doppler couleur.
Figure 17. Valvulopathie tricuspide d’origine dystrophique avec épaississement des feuillets et excès tissulaire.
Figure 18. Endocardite infectieuse sur valve tricuspide avec volumineuse végétation appendue à la valve antérieure visible en diastole (A) et en systole (B).
Figure 19. Lésion traumatique de la valve tricuspide. On note un capotage du feuillet antérieur (flèche).
Les fuites fonctionnelles
Elles sont dues à une dilatation et une déformation (aplatissement) annulaires, en rapport avec une dilatation du VD, de l’OD ou des deux cavités droites.
Les étiologies sont les shunts gauche-droit à l’étage auriculaire (communications interauriculaires ou retours veineux anormaux partiels), les hypertensions artérielles pulmonaires (d’origine pré- ou post-capillaire), plus rarement les dilatations de l’anneau tricuspide sur fibrillation atriale ancienne. Lorsque le VD est dilaté, le mécanisme est double : dilatation annulaire avec défaut de coaptation central et restriction du jeu systolique des feuillets par éloignement des muscles papillaires, responsable d’un aspect systolique en forme de tente (« tenting » des Anglo-Saxons) (figure 20).
Figure 20. Volumineuse fuite tricuspide fonctionnelle. On note un large défaut de coaptation central.
Quantification des fuites tricuspides
L’approche de la quantification des fuites valvulaires s’est profondément modifiée au cours de ces dernières années. Les indices évalués à l’origine du jet, comme la zone de convergence ou la vena contracta, ont été propulsés au premier plan, grâce aux travaux in vitro qui ont démontré leur pertinence. À l’inverse, le comportement du jet dans la cavité réceptrice (extension, surface du jet) est sous la dépendance de nombreux critères et peut parfois conduire à des diagnostics erronés, tant par excès que par défaut. Les principaux critères de quantification des insuffisances tricuspides sont les mêmes que ceux proposés pour une insuffisance mitrale, mais sont globalement beaucoup moins solidement validés dans la littérature.
Visualisation du jet en Doppler couleur
L’extension du jet dans l’oreillette droite est toujours évaluée, qu’on le veuille ou non, l’œil étant forcément attiré par le comportement du jet dans l’oreillette. Si ce coup d’œil permet une approche grossière de la quantification (fuite minime si la surface est < 5 cm2, fuite modérée à moyenne entre 5 et 10 cm2, fuite importante si la surface est > 10 cm2), il peut parfois être responsable de faux diagnostics : forte extension du jet en cas de pression élevée dans le ventricule droit en systole (HTAP, sténose pulmonaire) alors que la fuite est modeste, faible extension dans les jets de direction excentrée même si la fuite est importante…
La vena contracta a été validée en ETO, puis en ETT, d’abord pour quantifier les IM et les IA, puis très rapidement pour les IT (Tribouilloy). Pour ces trois régurgitations, un seuil entre 6 et 8 mm, est apparu comme très spécifique pour parler de fuite importante. Ainsi, un diamètre ≥ 6,5 mm pour une IT identifie une fuite importante avec une sensibilité de 89 % et une spécificité de 93 %. On ne dispose pas actuellement de données suffisantes pour proposer des seuils afin d’identifier les fuites modérées ou moyennes. Compte tenu des petites valeurs mesurées, les erreurs de mesure ont des implications diagnostiques évidentes.
Il est nécessaire d’obtenir les trois parties du jet (convergence, vena contracta et extension) sur la même image pour effectuer la mesure, sinon les risques de surestimation sont majeurs.
Le zoom doit être utilisé ainsi que la plus grande profondeur d’image possible ; la taille du secteur couleur sera réduite au maximum. Ces manœuvres permettent d’optimiser la résolution ; toutefois, la résolution latérale demeure significativement moins bonne que la résolution axiale, et la mesure de l’IT, très souvent effectuée par voie apicale, souffre de cette limite (figure 21).
Figure 21. Étude de l’origine du jet d’insuffisance tricuspide en Doppler avec mesure de la vena contracta.
La mesure de la zone de convergence (ou PISA, proximal isovelocity surface area), se base sur le même principe que pour les régurgitations gauches :
• visualisation de la PISA dans le ventricule droit immédiatement avant la valve tricuspide ;
• optimisation de la zone à analyser en zoomant et en abaissant la ligne du zéro de la couleur (afin d’obtenir un rayon mesurable de la convergence entre le plan de la valve d’un côté et la limite d’aliasing de l’autre) (figure 22) ;
• le rayon R mesuré est celui d’un hémisphère d’isovitesses Va dont la surface représente le débit régurgité instantané : 2πR2 x Va.
Figure 22. Visualisation de la zone de convergence d’une fuite tricuspide. La vitesse d’aliasing a été réglée à 28 cm/s.
La surface de l’orifice régurgitant (SOR) se calcule selon la formule :
[2πR2 x Va]/VmaxIT
Dans le cadre de l’IT, cette formule va sous-estimer la SOR, pour au moins deux raisons :
- le profil de vitesse quand on est proche de l’orifice est très aplati et s’éloigne nettement du modèle hémisphérique, et il est nécessaire d’introduire un facteur correctif (VIT/VIT-Va) (Rivera) ;
- le plan de la valve ayant une forme en entonnoir retourné, l’angle alpha formé par les feuillets est supérieur à 180°, et la formule doit être corrigée d’un facteur (alpha/180°).
Ainsi, la SOR=[(2πR2 x Va) x (VmaxIT/VmaxIT-Va) x (alpha/ 180)]/VmaxIT
La complexité de la formule et la difficulté de mesure de l’angle alpha rendent cette approche difficile en routine. Elle permet toutefois d’obtenir de bons résultats : en prenant un seuil de SOR à 0,4 cm2, la sensibilité est de 94 % et la spécificité de 89 % pour le diagnostic de fuite sévère (Tribouilloy).
L’ASE propose une approche pragmatique un peu réductrice proposant de régler la Va de façon fixe à 28 cm/s et de raisonner selon R. R > 9 mm serait en faveur d’une grosse fuite, R > 5 mm d’une fuite modérée, les fuites moyennes ayant un R entre 6 et 9 mm (Zoghbi).
Doppler pulsé/Doppler continu
Le pic de l’onde E du flux transtricuspide est un élément d’orientation. Il augmente parallèlement à l’hyperdébit secondaire à la fuite : plus la fuite est importante, plus le pic E est ample ; mais, bien sûr, ce signe n’est pas très spécifique, car il est présent en cas de sténose tricuspide, de pressions de remplissage élevées…
La morphologie du flux d’IT peut orienter vers une fuite importante, en particulier une morphologie triangulaire à pic précoce (grande onde v liée à une élévation de la pression auriculaire droite, liée à l’importance de la fuite). En Doppler pulsé, le caractère laminaire de la fuite (suspectée en Doppler couleur, figures 23 et 24) est important à diagnostiquer : il est très évocateur de fuite tricuspide importante et sous-estime toujours le niveau de pression intraventriculaire droite systolique (parfois de façon très importante).
Figure 23. Volumineuse fuite tricuspide laminaire visualisée en Doppler couleur (aspect homogène du flux sans aliasing).
Figure 24. Même patient que figure 23, on visualise l’aspect laminaire du flux d’insuffisance tricuspide à basse vitesse en Doppler pulsé.
L’interrogation du flux veineux sus-hépatique en Doppler pulsé est très utile (figure 25) : l’amplitude de l’onde S diminue avec l’importance de la fuite et, en cas de fuite sévère, on note une inversion de la composante systolique (Diebold).
Figure 25. Enregistrement du flux veineux sus-hépatique en Doppler pulsé démontrant un reflux systolique (flèches), témoin d’une fuite tricuspide importante.
L’inversion de S semble très spécifique de fuite importante (pas d’évaluation claire dans les études). Il est important de noter qu’une élévation importante de POD et la FA sont des facteurs qui vont eux-mêmes diminuer nettement l’amplitude de S.
En pratique
Dans la pratique courante, les trois paramètres recommandés (tableau 1) pour quantifier les fuites tricuspides sont la vena contracta, la SOR et l’aspect de S sur le flux veineux sus-hépatique (Abergel). Couplés à l’analyse de la taille des cavités droites et du mécanisme de la fuite, ils permettent une évaluation satisfaisante de l’importance de la fuite tricuspide dans la majorité des situations.
Indications chirurgicales
Les valvulopathies tricuspides accompagnent très souvent une valvulopathie du cœur gauche, soit qu’il s’agisse d’une fuite tricuspide fonctionnelle secondaire à une HTAP chronique, soit que la valvulopathie soit d’origine rhumatismale avec des lésions sur plusieurs valves. Les indications chirurgicales seront bien entendu différentes selon que l’on ait à corriger uniquement une lésion tricuspide ou que l’indication soit portée à cause d’une autre anomalie valvulaire et que l’on y associe un geste sur la valve tricuspide. Un problème particulier concerne les insuffisances tricuspides fonctionnelles secondaires à une atteinte du cœur gauche (le plus souvent une valvulopathie mitrale) mais dont la correction a été effectuée et réussie plusieurs années auparavant. Les recommandations des sociétés savantes américaines et européennes sont assez concordantes mais restent basées sur un consensus d’experts, les données scientifiques solides étant très limitées dans ce domaine (tableau 2).
Valvulopathie tricuspide isolée
Sténose tricuspide
Une sténose tricuspide serrée symptomatique relève clairement d’un geste, quelle qu’en soit l’étiologie (rhumatismale ou rarement carcinoïde). Il s’agira pratiquement toujours d’un remplacement valvulaire tricuspide. Quelques cas de dilatation tricuspide percutanée ont été rapportés mais leur nombre est insuffisant pour conclure et le risque de fuite tricuspide parait non négligeable. S’agissant souvent de patients jeunes, un geste chirurgical est le plus souvent préférable. Le risque thrombotique des prothèses mécaniques en position tricuspide est tel que ce sont les bioprothèses qui sont proposées par les recommandations américaines, européennes et françaises.
Insuffisance tricuspide
Lorsqu’elle est isolée, elle est longtemps bien tolérée cliniquement. Progressivement, la fonction ventriculaire droite peut s’altérer et on sait la difficulté à évaluer précisément ce paramètre. Il est donc souvent difficile de définir de façon formelle le « bon moment » pour proposer un geste chirurgical. Ceci est d’autant plus vrai qu’il s’agit d’une fuite tricuspide organique qui a toute chance d’aboutir à un remplacement valvulaire. En effet, comme pour l’insuffisance mitrale, une chirurgie conservatrice est préférable au remplacement valvulaire. Elle est cependant rarement possible en cas de lésion rhumatismale (tissus rigides et rétractés) et de façon inconstante en cas de lésion traumatique ou infectieuse. Ceci explique le niveau moins élevé dans les différentes recommandations. Ainsi, une fuite tricuspide sévère symptomatique isolée est une indication à la chirurgie de classe IIa pour les Américains, de classe I pour les Européens et admise (mais non formelle) pour les Français. Il est important de préciser que, dans les recommandations européennes, l’indication est de classe I si la fonction VD n’est pas altérée de façon « sévère » (aucun critère quantitatif n’étant fourni). Ceci souligne l’importance du suivi des symptômes et de la fonction VD chez ces patients pour la décision opératoire.
Valvulopathie tricuspide associée à une atteinte du cœur gauche
Lésion initiale
On entend par là une lésion de la tricuspide dont le diagnostic est effectué en même temps que celui de la valvulopathie gauche. Il se pose donc la question d’associer un geste sur la valve tricuspide sachant que l’indication opératoire est posée sur les données du cœur gauche (par exemple une maladie mitrale symptomatique). Une fuite ou une sténose tricuspide sévère fera l’objet d’un geste associé à celui du cœur gauche. Il s’agit d’une indication de classe I pour les Américains et les Européens, et formelle pour les Français.
Plus difficile est la question des fuites tricuspides moyennes ou a fortiori modérées associées à une valvulopathie gauche. Faut-il associer un geste sur la tricuspide ? Plusieurs travaux ont montré qu’il n’est pas rare de voir s’aggraver une fuite tricuspide après une correction chirurgicale de valvulopathie gauche. De plus, on sait que la quantification d’une fuite tricuspide n’est pas toujours simple et que son volume peut varier de façon importante en fonction des conditions de charge. Des travaux récents ont pointé l’importance de la mesure de la dilatation annulaire indépendamment du volume de la fuite pour décider d’une éventuelle correction. Comme nous l’avons vu, cette mesure n’est pas encore parfaitement standardisée en échographie. La mesure en 4 cavités en diastole, bien que peu logique (cf. supra), est celle effectuée en routine. Une valeur > 40 mm ou 21 mm/m2 SC est la seule proposée (dans les recommandations européennes). Ceci amène donc à mettre en classe IIa (recommandations européennes) ou IIb (américaines), les fuites tricuspides moyennes avec dilatation annulaire si une lésion doit être corrigée à gauche.
Le risque lié à une reprise secondaire et la relative simplicité d’une annuloplastie tricuspide pour simple dilatation annulaire plaident pour une correction lors du geste initial. Ici encore, le rôle de l’échocardiographie est crucial puisque c’est l’analyse anatomique soigneuse de l’appareil valvulaire tricuspide qui va guider le chirurgien dans son geste.
Lésion tardive
Il s’agit de l’apparition, ou plus souvent de l’aggravation, d’une fuite tricuspide après la correction d’une valvulopathie du cœur gauche. Ceci peut se produire dans un délai très variable mais parfois court. La prise en charge de cette pathologie est difficile car le risque d’une réintervention dans ce contexte est élevé. En effet, il s’agit de patients déjà opérés avec souvent une HTAP chronique, une fonction VD altérée, voire une altération associée de la fonction VG. L’attitude médicale est donc le plus souvent poursuivie longtemps. Cependant, chez certains patients, le bénéfice de l’intervention apparaît supérieur au risque, notamment si la fonction VD n’est pas trop altérée. L’indication est donc admise pour les recommandations françaises en cas d’IT volumineuse symptomatique sans HTAP ni dysfonction valvulaire ou ventriculaire gauche et sans dysfonction sévère du VD. Pour les mêmes auteurs, il n’y a pas d’indication si la fonction VD est très altérée, s’il existe une HTAP ou si la fonction VG est altérée. Les recommandations européennes vont dans le même sens (classe IIa en l’absence de dysfonction VG ou VD et avec une PAPs < 60 mmHg, classe IIb si la fonction VD est altérée). Les recommandations américaines n’isolent pas ce cas particulier des fuites tricuspides à distance d’une chirurgie valvulaire.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :








