Polémique
Publié le 28 fév 2015Lecture 5 min
La défibrillation sans sonde endocavitaire - L’avenir de la défibrillation implantable ?
C. MARQUIÉ, CHRU de Lille
En 1970 Michel Mirowski met au point le premier défibrillateur automatique implantable (DAI) et publie en 1980 son expérience de la première implantation de ce système à trois êtres humains(1).
Un peu d’histoire
En 1970 Michel Mirowski met au point le premier défibrillateur automatique implantable (DAI) et publie en 1980 son expérience de la première implantation de ce système à trois êtres humains(1).
Depuis, cette technique n’a cessé de progresser tant en ce qui concerne ses indications et ses progrès technologiques que le nombre de patients implantés.
Ces 35 dernières années ont vu le système externe au patient pesant plus de 10 kg se transformer en un petit appareil implantable, de moins de 80 g qui, en plus de traiter les troubles du rythme cardiaque, dispose d’une fonction de stimulation et de resynchronisation si nécessaire (tableau). Aujourd’hui, plus de 300 000 DAI sont implantés par an dans le monde, dont 12 000 en France.
Le DAI sans sonde endocavitaire : à quoi ça ressemble et est-ce que ça marche ?
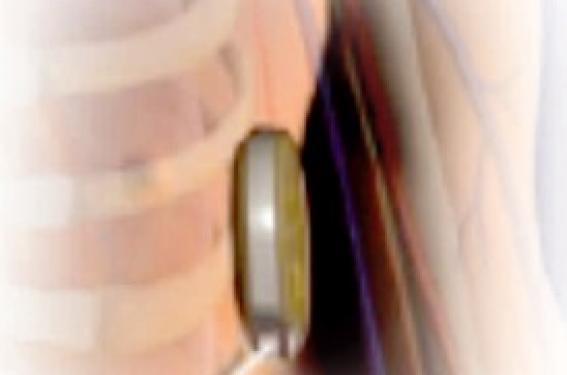
Le matériel actuellement commercialisé est entièrement sous-cutané, composé d’un boîtier et d’une sonde de défibrillation. Le boîtier est positionné dans la région basithoracique gauche, sur la ligne axillaire moyenne, en position prémusculaire (figure). La durée de vie de l’appareil est estimée à 5 ans en utilisation classique avec une capacité d’environ 100 chocs. La détection se fait de manière bipolaire selon trois possibilités. Il est possible de programmer une ou deux zones de thérapies (programmables entre 170 et 250/min). Le traitement est le même dans les deux zones, à savoir des chocs de 80 joules. Dans la zone la plus basse, il est possible d’activer un algorithme de discrimination basé sur la morphologie. Il n’y a pas de fonction de stimulation, hormis en post-choc (optionnelle, durant < 30 s à 50/min).
Schéma illustrant le positionnement sous-cutané du boîtier et de la sonde qui est placée dans cet exemple en parasternal gauche. : 1 - Électrode distale de détection : 2 - Électrode proximale de détection : 3 - Boîtier
Les trois flèches de couleur représentent les 3 vecteurs possibles pour la détection. Flèche jaune « vecteur primaire » entre l’électrode proximale et le boîtier. Flèche rouge « vecteur secondaire » entre l’électrode distale et le boîtier. Flèche bleue « vecteur supplémentaire » entre les électrodes proximale et distale. Boîtier : Volume 69 cc, dimensions 78,2 x 65,5 x 15,7 mm, 145 g. Sonde : longueur totale 45 cm, longueur du coil 8 cm, diamètre maximal 3 mm.
Fin 2014, environ 4 000 défibrillateurs sous-cutanés (S-ICD) ont été implantés (180 en France) et plus de 1 200 patients ont été inclus dans des études cliniques ou des registres. Le taux de réduction d’une TV ou d’une FV spontanées va de 95,5 à 100 % selon les études, avec 10 % de chocs inappropriés sur les premiers modèles et de 7 % dans le registre EFFORTLESS(2-3). Dans ce même registre, l’efficacité du premier choc est de 88 %, et de 100 % au terme des 5 chocs. On note un taux de complications (implantation et suivi) de 6,4 % au terme d’un suivi d’un peu plus de 18 mois(3). Aucune fracture de sonde n’a été rapportée à ce jour.
Certains points ne sont cependant pas totalement réglés à ce jour, en particulier la fiabilité du système et la robustesse de la sonde à long terme du fait du caractère récent de son utilisation. Il manque également une étude randomisée comparant le S-ICD et le défibrillateur avec sonde endocavitaire : l’étude PRAETORIAN devrait répondre à cette attente(4).
Quel est l’intérêt d’un matériel entièrement sous-cutané ?
Les DAI ont montré leur efficacité sur la mortalité(5-6), mais ils ne sont pas sans problèmes associés.
Le problème des sondes
Les sondes sont le point faible des défibrillateurs endocavitaires : du fait des contraintes mécaniques, elles peuvent se fracturer. La fracture de sonde nécessite l’ajout d’une nouvelle sonde et l’extraction de la sonde lésée. La fracture est plus fréquente chez les patients jeunes, après un changement de boîtier, ou elle peut être l’évolution naturelle d’une sonde après quelques années de fonctionnement.
Ces dernières années ont aussi été marquées par des vices de fabrication aboutissant à un taux de dysfonctionnement supérieur à celui attendu. En parallèle, les indications de DAI s’élargissent d’où une population implantée plus grande, confrontant plus fréquemment le cardiologue à la problématique de la fracture de sonde. L’extraction de sonde endocavitaire est techniquement compliquée. Les facteurs de risque de complications des extractions de sonde de DAI sont l’ancienneté des sondes, leur nombre et l’infection.
L’infection
L’autre problématique est le risque d’infection de matériel et le risque inhérent d’endocardite. L’infection touche en moyenne 2 à 6 % de cette population et contraint à l’extraction du matériel(7). Enfin, notons une population, certes plus rare, de patients hétérogènes :
• ceux porteurs de cardiopathies congénitales chez qui l’implantation du matériel endocavitaire relève plus de la performance à la MacGyver ;
• les patients qui ont déjà eu des problèmes infectieux ;
• les patients dialysés ou porteurs de cathéters en tout genre ;
• enfin, ceux qui vieillissent avec leur maladie, qui ont d’abord eu un stimulateur avec deux sondes, puis trois, puis un DAI… Dans cette population, la problématique des accès veineux, des fractures de sonde et du risque infectieux est encore plus présente.
Alors un dispositif entièrement sous-cutané, sans sonde endocavitaire, donc sans risque d’endocardite, et dont la procédure d’extraction serait simplifiée du fait de sa position sous-cutanée, seraitil utile ? La réponse est OUI.
Le DAI sans sonde endocavitaire est-il l’avenir de la défibrillation ?
Bien entendu pas en l’état actuel, car nous sommes exigeants : on aimerait qu’il soit moins gros, délivre une stimulation antitachycardique, dispose de la télésurveillance, soit IRM compatible, soit plus accessible dans la compréhension de son mode de fonctionnement, dispose d’un peu de souplesse dans son réglage, et qu’on puisse le coupler à une stimulation antibradycardique.
De même que nous souhaitons que les stimulateurs sans sonde progressent, cette première génération de DAI sans sonde endocavitaire va évoluer. Il est certain que nous sommes à un tournant technologique, et au vu de ce qui s’est fait en 30 ans, gageons que ce qui modère notre enthousiasme aujourd’hui sera corrigé demain.
Alors, j’ai fait un rêve…
Un rêve dans lequel, on pourrait implanter 1, 2 ou 3 petites capsules dans l’oreillette, le ventricule droit, le ventricule gauche, qui seraient couplées à du matériel de défibrillation sous-cutané… Puis, il y aurait aussi un petit capteur de pression dans l’artère pulmonaire ou l’oreillette gauche, une petite puce sous la peau du patient mesurant les constantes biologiques (natrémie, créatininémie, INR), le tout accessible par télésurveillance…
Nous n’en sommes pas là, et la technologie ne remplace pas le bon sens du clinicien, mais elle sauve des vies et a déjà considérablement modifié et amélioré notre condition d’exercice de soignant ces 30 dernières années.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


