Cardiologie interventionnelle
Publié le 31 mai 2013Lecture 11 min
Thrombose de stent en 2013
G. CAYLAa,b J.-S. HULOTb, J. SILVAINb, G. MONTALESCOTb et J.-P. COLLETb a. Service de cardiologie, CHU de Nîmes b. Institut de cardiologie, Hôpital de la Pitié-Salpêtrière, Unité INSERM 937, Groupe ACTION

L’angioplastie coronaire est née en 1977 à Zurich et a connu un développement exceptionnel avec la pose du premier stent par Jacques Puel en 1986. Les premières études font état, avec l’association d’aspirine et d’anticoagulant, d’un taux de thrombose de stent de 25 % à 30 jours. L’utilisation des thiénopyridines en association avec l’aspirine, découverte française en 1991 par Paul Barragan, a sauvé le stent coronaire en réduisant de manière spectaculaire cette complication. Cependant, la thrombose de stent reste une complication multifactorielle et dramatique de l’angioplastie coronaire.
Une meilleure compréhension de ses mécanismes physiopathologiques, l’intensification des traitements antiplaquettaires et l’amélioration de la qualité des stents ont permis une diminution nette de cette compli - cation au cours des cinq dernières années. Le développement de plateformes totalement biorésorbables fait espérer une disparation des thromboses de stent.
Définition
La thrombose de stent est définie par l’occlusion aiguë d’un stent. La définition ARC (Academic Research Consortium) a permis de standardiser et de caractériser la thrombose de stent en fonction de la date de survenue et du niveau d’évidence de cette thrombose (figure 1)(1).
Figure 1. Classement des thromboses de stent en fonction du degré de certitude et du délai de survenue selon les critères ARC (Academic Research Consortium).
Incidence et pronostic de la thrombose de stent
Les thromboses de stent précoces (thromboses de stent aiguës et subaiguës) représentent environ deux tiers des thromboses de stent observées. Leur incidence varie de 1 à 3 % selon les études(2) avec une incidence plus importante dans l’angioplastie des syndromes coronariens aigus par comparaison avec l’angioplastie élective. La thrombose de stent tardive est plus rare, avec une incidence allant de 0,1 à 1 % selon les études et le type de stent. Enfin, les thromboses très tardives sont beaucoup plus rares et leur incidence annuelle varie de 0,1 à 0,5 % avec les stents actifs de première génération(3).
Le pronostic de la thrombose de stent reste sombre
L’infarctus, mode de présentation le plus fréquent, se caractérise par une masse thrombotique importante, des embols distaux fréquents, une reperfusion efficace plus difficile à obtenir et un taux élevé de récidive. Les données de registres font état d’une mortalité de 20 à 40 % pour les thromboses de stent précoces et de 5 à 10 % pour les thromboses de stent tardives et très tardives(4).
Physiopathologie et facteurs prédictifs de la thrombose de stent
La thrombose de stent est une maladie complexe et multifactorielle et de très nombreux facteurs de risque de thrombose de stent ont été identifiés (figure 2).
Figure 2. Principaux facteurs de risque impliqués dans la thrombose de stent.
Facteurs cliniques et angiographiques
Certains facteurs de risque, tels que la présence d’un diabète, d’une insuffisance rénale, l’altération de la fonction ventriculaire gauche, la présence d’une maladie artérielle périphérique et l’âge, sont liés au patient et ne sont pas modifiables.
Certains facteurs sont, quant à eux, liés à la procédure. L’angioplastie, dans un contexte de syndrome coronarien aigu, et spécifiquement l’infarctus avec sus-décalage sont de puissants facteurs de risque indépendants de thrombose de stent.
Dans l’étude HORIZONS-AMI(5), l’une des plus larges études d’angioplastie dans l’infarctus avec sus-décalage (n = 3 602 patients), le taux de thrombose de stent rapporté à 3 ans (certaine et probable) était de 4,8 % avec les stents au paclitaxel et 4,3 % avec les stents nus (p = 0,63). Par ailleurs, d’autres facteurs de risque liés à la procédure ont été rapportés : les lésions coronai res complexes (de type C selon la classification ACC/AHA), les calcifications coronaires, la présence d’une dissection coronaire résiduelle, les lésions de pontage et les malappositions de stent, les lésions de bifurcation, la présence d’un thrombus résiduel(6).
Les facteurs liés aux stents sont modifiables et varient en fonction du type de stent utilisé. On citera l’épaisseur de la maille, le type et la biocompatibilité du polymère, la longueur totale du segment stenté, le nombre total de stents, mais aussi le diamètre minimal du stent.
Les facteurs liés aux traitements antiagrégants plaquettaires et aux thiénopyridines
L’arrêt prématuré du traitement antiagrégant plaquettaire est le facteur de risque majeur de thrombose de stent(7). Le risque est d’autant plus grand que l’arrêt survient précocement après mise en place du stent et c’est majoritairement l’arrêt dans les 30 jours qui expose le patient à un risque très élevé de thrombose de stent.
La réponse biologique au clopidogrel apparaît comme l’autre facteur de risque majeur de thrombose de stent en rapport avec le traitement antiagrégant plaquettaire. De très nombreuses études ont fait un lien entre l’hyperactivité plaquettaire résiduelle sous clopidogrel et le risque de thrombose de stent(8). L’origine de cette variabilité de la réponse au clopidogrel est multifactorielle. Le clopidogrel est une prodrogue qui nécessite deux étapes clés de biotransformation pour générer son métabolite actif. La perte de fonction d’origine génétique du cytochrome hépatique P450 2C19 (CYP2C19) a été identifiée comme le facteur le plus important de la diminution de la génération de métabolite actif(9,10).
Une métaanalyse récente rapporte un risque de thrombose de stent multiplié par 4 chez le patient porteur de ce variant à l’état homozygote et par 2,7 chez le patient porteur du variant à l’état hétérozygote(11). L’étude ONASSIST est une étude cas-témoins récemment publiée par notre groupe(12), dont l’objectif était de réaliser une analyse systématique et simultanée des différents facteurs cliniques, angiographiques et génétiques associés à la thrombose de stent précoce chez les patients traités par aspirine et clopidogrel. Cette étude a confirmé l’impact majeur délétère du variant *2 (perte de fonction) du cytochrome CYP2C19 et retrouve pour la première fois dans la thrombose de stent une fréquence moindre du variant *17 (gain de fonction).
Nous avons pu développer un score de risque global, le score ONASSIST, qui englobe des facteurs cliniques et génétiques pour prédire le risque de thromboses de stent précoces (figure 3).
Figure 3. Étude ONASSIST(10), facteurs indépendants de thrombose de stent.
Thrombose de stent précoce versus tardive : une physiopathologie différente ?
La physiopathologie des thromboses de stent précoces et des thromboses tardives et très tardives est différente. La première est étroitement liée à la quantité finale de métabolite actif du clopidogrel disponible, alors que les thromboses de stent tardives et très tardives sont plutôt liées à des causes mécaniques tels la malapposition, le défaut de couverture de maille, l’inflammation locale et l’hypersensibilité liée au polymère, et les fractures de stent.
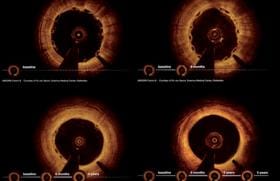
Des études ont récemment démontré que le néo-athérome pouvait constituer un substrat important dans la physiopathologie de la thrombose de stent très tardive (figure 4) et confirme que malgré l’implantation du stent, la pathologie athéromateuse peut continuer à progresser chez certains patients.
Figure 4. Description en OCT du néo-athérome (d’après Park J et al. JACC 2012 ; 59 : 2051-7).
Le registre français PESTO est actuellement en cours pour préciser en OCT les différents mécanismes des thromboses de stent tardive et la part du néo-athérome dans la physiopathologie des thromboses très tardives.
Vers une diminution de la thrombose de stent ?
Thrombose de stent précoce
Dans le contexte de syndrome coronaire aigu, l’utilisation de plus fortes doses de charge de clopidogrel (CURRENT OASIS 7), de nouveaux antiagrégants plaquettaires comme le prasugrel (TRITON) ou le t icagrélor (PLATO) ou l’ajout d’un inhibiteur du facteur Xa ont permis une diminution de 30 à 60 % du taux de thrombose de stent (figure 5a et 5b). Rappelons que les nouveaux inhibiteurs des récepteurs P2Y12 ne sont indiqués que dans la pathologie coronaire instable et que de nombreuses angioplasties à risque sont réalisées en dehors de ce contexte.
Figure 5. A : Efficacité des nouveaux inhibiteurs P2Y12 sur la thrombose de stent certaine dans le syndrome coronaire aigu. B : Efficacité du rivaroxaban sur le risque de thrombose de stent (certaines, probables ou possibles) comparativement au placebo.
Thrombose de stent tardive et très tardive
La physiopathologie des thromboses de stent tardives et très tardives est davantage liée au type de stent et à la procédure initiale (qualité de l’apposition du stent). Des progrès techniques considérables (figure 6) ont été réalisés par les différentes firmes pour améliorer les propriétés intrinsèques des stents actifs (stents actifs de nouvelle génération). La réduction de l’épaisseur des mailles, associée à l’utilisation de polymères biocompatibles ou biodégradables (acide polylactique ou polylactique co-glycoside), a permis une réduction d’environ 50 % du taux de thrombose de stent à 1 an et à 2 ans (figure 7). Les stents autoexpansibles ont été développés pour lutter contre les phénomènes de malappositions tardives dans l’angioplastie primaire de l’infarctus. Des études randomisées comparativement aux stents conventionnels dans l’infarctus aigu sont en cours. Enfin, les stents totalement biorésorbables ont un risque théorique de thrombose très tardive qui disparaît complètement avec la disparition du stent : celle-ci est variable en fonction des polymères utilisés mais souvent proche de 24 mois.
Figure 6. Évolution et améliorations des stents actifs contribuant à la réduction de la thrombose de stent.
Figure 7. A : Métaanalyse sur les stents CobaltChrome à l’évérolimus (Cocr-EES [stent 1]) montrant une réduction du taux de thrombose de stent (certaine et probable) en comparaison des stents actifs de première génération (PES-PC-ZEC [stent 2]) et aux stents nus (BMS [stent 2]). B : Métaanalyse montrant une réduction du taux de thrombose de stent avec le stent à polymère biodégradable par comparaison avec le polymère durable au sirolimus.
L’impact du traitement antiagrégant plaquettaire et la durée de la bithérapie par aspirine et clopidogrel sur la survenue des thromboses tardives reste débattu.
Les données récentes de la littérature ne sont pas en faveur d’une augmentation des thromboses de stent tardives lorsque le clopidogrel est stoppé 12 mois(13) et même 6 mois(14) après l’angioplastie en comparaison à une poursuite 24 mois après angioplastie. Des études randomisées évaluent la durée optimale de la bithérapie dans l’angioplastie coronaire stable. Certaines prothèses actives ont déjà obtenu un marquage CE pour une réduction de la bithérapie à 3 mois, voire à 1 mois. Mais cela ne correspond pas aux recommandations ni à des évaluation randomisées. Enfin, ces évaluations ne prennent pas en compte la progression de la maladie coronaire en dehors des segments stentés. Or, cette progression représente 50 % des récidives d’événements coronaires aigus après stenting coronaire.
Points clés
La thrombose de stent coronaire est une complication rare mais grave.
Les nombreux facteurs de risque rapportés sont soit liés au patient et sont généralement non modifiables, soit liés au stent, à la procédure et au traitement antiagrégant plaquettaire et sont généralement modifiables.
La thrombose de stent précoce (≤ 1 mois) a une physiopathologie différente de la thrombose de stent tardive (entre 1 mois et 1 an) et très tardive (au-delà de 1 an).
La thrombose de stent précoce est avant tout liée à l’inefficacité de la bithérapie antiagrégante plaquettaire et son arrêt prématuré en reste la principale cause.
Les facteurs cliniques et génétiques à l’origine d’une hyperactivité plaquettaire persistante sous clopidogrel majorent le risque de thrombose de stent précoce. L’utilisation de score de risque « clinico-génomique »permet l’identification des malades à risque.
Les nouveaux inhibiteurs du récepteur P2Y12 diminuent par deux le risque de thrombose de stent par rapport au clopidogrel.
Les stents actifs de dernière génération diminuent de 30 à 50 % le risque de thrombose de en comparaison des stents nus ou des stents actifs de première génération.
En pratique
La thrombose de stent est une complication grave de l’angioplastie coronaire dont l’incidence tend à diminuer mais qui a un impact sur la mortalité précoce et à long terme.
La thrombose de stent précoce est une maladie de l’inefficacité du clopidogrel (observance et défaut de métabolisme), alors que la thrombose tardive semble davantage liée aux caractéristiques du stent lui-même et à la paroi vasculaire.
L’utilisation de nouveaux inhibiteurs des récepteurs P2Y12 dans le contexte de syndrome coronaire aigu permet une diminution de la thrombose de stent.
En dehors des syndromes coronaires aigus, l’utilisation de scores « clinico-génomiques » pourrait aider à identifier les malades à haut risque de thrombose de stent précoce. Parallèlement, les améliorations techniques des stents de dernières générations ont permis de participer à la réduction observée de la thrombose de stent.
Déclarations d’intérêt
G. Cayla déclare des interventions en qualité de consultant pour les laboratoires Abbott Vascular, Astra Zeneca, CLS Behring, Daiichi Sankyo et Eli Lilly et des interventions en qualité d’intervenant pour les conférences organisées par les laboratoires Abbott Vascular, AstraZeneca, Boehringer Ingelheim, Bayer, CLS Behring, Daiichi Sankyo, Eli Lilly et Iroko Cardio.
G. Montalescot, Research Grants to the Institution or Consulting/Lecture Fees from Abbott Vascular, Astra- Zeneca, Bayer, Biotronik, Boehringer Ingelheim, Boston Scientific, Cleveland Clinic Foundation, Cardiovascular Research Foundation, Cordis, Daiichi Sankyo, Duke Institute, Eli Lilly, Europa, Fédération française de cardiologie, Fondation de France, GSK, ICM, INSERM, Leadup, Medtronic, Menarini, Nanospheres, Novartis, Pfizer, Sanofi-Aventis Group, Servier, Société française de cardiologie, Stentys, The Medicines Company, TIMI group.
J.-P. Collet, Research Grants to the Institution or Consulting/Lecture Fees from Abbott Vascular, AstraZeneca, Bayer, Biotronik, Boehringer Ingelheim, Boston Scientific, Cleveland Clinic Foundation, Cardiovascular Research Foundation, Cordis, Daiichi Sankyo, Duke Institute, Eli Lilly, Europa, Fédération française de cardiologie, Fondation de France, GSK, ICM, INSERM, Medtronic, Nanospheres, Sanofi-Aventis Group, Société française de Cardiologie, The Medicines Company.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :