Diabéto-Cardio
Publié le 19 juin 2007Lecture 11 min
Insulinothérapie et diabète de type 2
M.-L. VIRALLY, CHU Lariboisière, Paris
L’hyperglycémie du diabète de type 2 est liée à un déclin progressif de la sécrétion d’insuline. Ainsi, le diabète de type 2 évolue inexorablement vers une augmentation progressive de l’HbA1c. C’est la diminution progressive de la sécrétion d’insuline qui explique l’échappement thérapeutique, au début aux règles hygiéno-diététiques, puis à la monothérapie et à la bithérapie. L’équilibre glycémique est une condition nécessaire à la prévention des complications aiguës et chroniques du diabète et nécessite une intensification thérapeutique. Les nouvelles recommandations de l’HAS-AFSSAPS ont pour objectif de préciser les modalités de prise en charge des diabétiques, en particulier l’intensification thérapeutique. Les objectifs glycémiques sont revus à la baisse en maintenant idéalement une HbA1c ≤ 6,5 %. L’objectif national de santé publique est le maintien de l’HbA1c à une valeur ≤ 7 %.
Cela explique que la stratégie thérapeutique actuelle s’inscrive dans une stratégie d’intensification qui aboutit, tôt ou tard, à une insulinothérapie pour la plupart des patients. Ainsi, un patient diabétique de type 2 sera 10 à 15 ans après la découverte du diabète traité par insuline.
Prérequis indispensable à l’instauration d’une insulinothérapie chez le diabétique de type 2
Conviction du patient et du médecin
Les patients doivent être informés, tôt dans l’histoire du diabète, des étapes d’intensification du traitement et de la nécessité probable du recours à l’insuline 10 à 15 ans après la découverte de la maladie.
Un des principaux obstacles à l’insulinothérapie est la réticence psychologique du patient mais également celle du médecin. Le passage à l’insuline est souvent une étape difficile. Il faut avant tout que le médecin soit convaincu pour convaincre son patient. Aux représentations négatives des patients et médecins (signe de gravité, amputation, cécité, d’irréversibilité, crainte irrationnelle de dépendance, contrainte de l’autosurveillance, douleurs de l’injection, prise de poids…) doivent succéder des messages convaincants et rassurants comme le meilleur contrôle glycémique, l’efficacité du traitement, l’amélioration de la forme physique et la prévention des complications. Les patients et les médecins doivent savoir que l’insulinothérapie n’est pas un marqueur de gravité, mais au contraire, un traitement de prévention des complications.
Connaissance des objectifs glycémiques
Avant toute prise en charge, les patients diabétiques doivent connaître leurs objectifs glycémiques, qui sont en général compris entre 0,7 et 1,10 g/l (ou 0,8 à 1,20 g/l) avant les repas, et entre 1,0 et 1,50 g/l 2 heures après les repas. Ces objectifs sont stricts en raison de la corrélation entre la glycémie du réveil et le taux de l’HbA1c. Un taux d’HbA1c < 7 %, correspond à une glycémie à jeun avoisinant 1,00 g/l. L’HbA1c optimale doit être inférieure ou égale à 6,5 %. Ces objectifs sont évidemment variables et doivent être adaptés pour chaque patient selon l’âge, l’ancienneté du diabète, les complications vasculaires et les conséquences potentielles d’une hypoglycémie iatrogène.
Pratique de l’autosurveillance glycémique
Pratiquer l’autosurveillance des glycémies capillaires est indispensable pour adapter les doses d’insuline (et éventuellement celle du sulfamide).
Le matériel d’autosurveillance est aujourd’hui facile d’emploi avec une lecture des résultats en moins de 5 secondes. L’éducation du patient est souvent difficile en dehors des services de diabétologie, et peut nécessiter le recours transitoire à une infirmière.
L’insulinothérapie peut être transitoire dans certaines circonstances
Il existe des circonstances où le recours à l’insuline est obligatoire et transitoire. Tel est le cas d’une complication métabolique aiguë du diabète (décompensation hyperosmolaire ou cétosique favorisée par un contexte infectieux), de pathologies intercurrentes qui déséquilibrent le diabète (infections sévères, interventions chirurgicales, corticothérapie) ou d’événements cardiovasculaires graves (infarctus du myocarde, syndrome coronarien aigu, accident vasculaire cérébral, ischémie critique des membres inférieurs), de complications du diabète (mal perforant plantaire, neuropathie hyperalgique des membres inférieurs), de pathologies respiratoires aiguës. La grossesse survenant chez une diabétique de type 2 est également une indication formelle à une insulinothérapie intensive, les antidiabétiques oraux étant contre-indiqués. L’insulinothérapie est également nécessaire, transitoirement ou définitivement, en cas de contre-indication à la poursuite des antidiabétiques oraux (insuffisance rénale, hépatique…).
L’insulinothérapie définitive du DT2
À partir de quels seuils d’HbA1c et quelles valeurs de glycémies ?
Lorsque l’hyperglycémie persiste, en dehors de toute situation aiguë, et malgré le respect des règles hygiéno-diététiques, une activité physique régulière et un traitement oral maximal, cela veut dire que l’insulinothérapie devient nécessaire. Le patient devient un diabétique de type 2 insulinotraité ou insulinonécessitant, c'est-à-dire que l’insuline est nécessaire au contrôle glycémique. Le point essentiel des nouvelles recommandations, est l’abaissement de l’objectif glycémique « traiter plus tôt, plus vite, plus fort ».
Ainsi, le passage à l’insuline est recommandé :
- en cas d’échec de la bithérapie par antidiabétique oral (ADO) (HbA1c ≥ 7 %) , il est recommandé soit un essai d’une trithérapie orale (metformine + sulfamides + glitazones), soit d’emblée pour l’adjonction d’insuline aux ADO ;
- en cas d’échec de la trithérapie (HbA1c > 8 %), il convient d’arrêter les glitazones et d’assurer le passage à l’insuline.
Première étape : instauration de l’insuline à 1 injection par jour
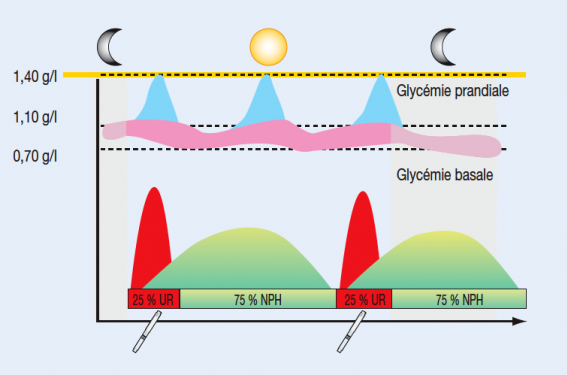
L’insulinothérapie en une seule injection le soir au coucher associée au traitement antidiabétique oral représente une première étape. Ce schéma appelé « bed-time » pour insuline à « l’heure du coucher », est donc une bonne transition. Les contraintes sont limitées à une seule injection d’insuline par jour faite avec un stylo, ce qui facilite l’éducation et l’acceptation. L’objectif de ce schéma est de diminuer la production hépatique de glucose nocturne pour ramener la glycémie à jeun au-dessous de 1,20 g/l (figure 1).
Figure 1. Schéma d’insulinothérapie « bed-time ». La courbe du haut représente les profils physiologiques sur le nycthémère de la glycémie basale (en rose) et des excursions glycémiques post-prandiales (en bleu). L’insuline « bed-time » consiste à faire une injection au coucher d’une insuline semi-lente type NPH (en vert) ou d’un analogue lent (en mauve). Les antidiabétiques oraux sont poursuivis.
Garder les anti-diabétiques oraux
Il est préférable de garder les antidiabétiques oraux avec l’injection d’insuline car cela réduit les besoins en insuline de 20 à 60 %. On maintient l’association metformine et sulfamides en adaptant la posologie des sulfamides pour que la glycémie de fin d’après-midi soit comprise entre 0,80 et 1,20 g/l. Il faut privilégier l’association à la metformine car la prise de poids et la fréquence des hypoglycémies sont moindres et l’équilibre glycémique meilleur.
Choix des insulines
Le choix portera sur les insulines de moyenne durée d’action (12 h, type NPH) ou les analogues de longue durée d’action : glargine (Lantus®) ou détémir (Lévémir®). Les propriétés pharmacocinétiques des analogues lents, sans pic plasmatique, ont l’avantage de limiter le nombre d'hypoglycémies.
Adaptation de la dose d’insuline et règles
L’adaptation des doses d’insuline est très simple, se fait par titration progressive adaptée, de 2 en 2 unités tous les 2 à 3 jours, afin d’atteindre les objectifs glycémiques. Il n’y a pas de limite supérieure à la dose, qui peut être supérieure à 80 unités. Le traitement peut être commencé en ambulatoire (figure 2).
Figure 2. Adaptation de la dose d’insuline du soir. L’adaptation doit se faire par titration progressive adaptée, de 2 en 2 unités tous les 2 à 3 jours, pour obtenir une glycémie au réveil dans l’objectif fixé par le médecin (0,7 à 1,10 g/l le plus souvent).
Le traitement par insuline doit permettre l’obtention d’un bon contrôle glycémique. Il est capital que les patients soient éduqués à l’autosurveillance glycémique, ils doivent contrôler leur glycémie une fois par jour le matin au réveil (et en fin d’après-midi en cas d’association d’un sulfamide). Les objectifs glycémiques à jeun sont fixés par le médecin. La dose initiale est modeste (10 à 12 unités le soir), mais il faut impérativement éduquer le patient à la nécessité d’adapter régulièrement la dose d’insuline tant que l’objectif glycémique du réveil n’est pas atteint (en général 0,80 à 1,20 g/l, rappelons-le). La dose prescrite est souvent insuffisante en raison de la crainte de prise de poids et d’hypoglycémies nocturnes. Il n’y a pas de limite supérieure ou de dose maximale à utiliser. La dose moyenne d’insuline nécessaire pour atteindre l’objectif varie selon le poids des patients, elle est en moyenne de l’ordre de 0,5 U/kg/j, mais parfois davantage. Il ne faut donc pas hésiter à majorer les doses. Actuellement, les injections se font au stylo qui supporte bien la température extérieure, les horaires des injections sont celles des repas.
En cas de contre-indication aux ADO : 2 injections par jour
En cas de contre-indication des ADO, on proposera dans un premier temps, un schéma à 2 injections qui associe un mélange d’analogue rapide à une insuline intermédiaire. Ceci est une bonne étape avant le schéma intensifié (figure 3).
Figure 3. Schéma à 2 injections d’insuline par jour. La courbe du haut représente les profils physiologiques sur le nycthémère de la glycémie basale (en rose) et des excursions glycémiques post-prandiales (en bleu). Le schéma associe un mélange d’analogue rapide (contrôle des glycémies post-prandiales) à une insuline intermédiaire (contrôle de la glycémie basale). Ce schéma nécessite 2 injections par jour à l’heure des petits-déjeuner et dîners.
Deuxième étape : l’intensification de l’insulinothérapie
Du fait de l’aggravation progressive de l’insulinosécrétion, l’équilibre glycémique va échapper au schéma «bed-time» en quelques mois ou années. Avant d’affirmer que l’insulinothérapie basale ne suffit plus, il faut s’assurer d’une bonne titration de l’insuline, du respect des règles hygiéno-diététiques et de la bonne observance thérapeutique. Le traitement par insuline doit être intensifié si l’HbA1c reste pendant 6 mois > 8 % (7 % en cas de rétinopathie). Le passage à deux injections d’insuline semi-lente ou biphasique ne semble pas apporter de bénéfice en termes de contrôle glycémique comparé à l’insuline au coucher. Dans ce contexte, le passage aux multi-injections est plus approprié. Il est préférable de maintenir la metformine ; les sulfamides peuvent être arrêtés.
Le schéma insulinique doit dans l’idéal reproduire au mieux le profil physiologique de la sécrétion d’insuline. L’avènement des analogues de l’insuline, rapides et lents, améliore la maniabilité et la précision de ces schémas. Les propriétés des analogues lents permettent une bonne couverture des besoins en insuline basale. La pharmaco-cinétique des analogues rapides (lispro ou Humalog®, aspart ou Novorapide®, glulisine ou Apidra®) caractérisée par un délai d’action quasi immédiat, un pic et une durée d’action courte (2-3 heures) permet de bien contrôler les excursions glycémiques postprandiales.
Ce type de schéma « basal-bolus » permet une grande maniabilité avec une modalité d’adaptation des doses très simples : l’insuline basale s’adapte selon la glycémie du réveil, et les insulines ultrarapides injectées avant les repas, selon les glycémies post-prandiales (figure 4). L’insuline rapide, dont l’injection doit se faire au moins 20 minutes avant le repas, avec un risque plus élevé d’hypoglycémie à distance des repas, n’est plus utilisée. L’augmentation du nombre d’injections doit aller de pair avec l’augmentation de l’autosurveillance glycémique afin d’adapter chacune des injections d’insuline. Ce type de schéma intensifié multi-injections (au moins quatre injections par jour) permet également l’élargissement et la libéralisation du régime alimentaire.
Figure 4. Schéma d’insulinothérapie intensifiée multi-injections. La courbe du haut représente les profils physiologiques sur le nycthémère de la glycémie basale (en rose) et des excursions glycémiques post-prandiales (en bleu). Les besoins en insuline basale sont couverts par une injection d’un analogue lent (mauve). Le contrôle des glycémies post-prandiales est couvert par une injection d’un analogue rapide (rouge) avant chaque repas. La dose d’analogue rapide est adaptée à la quantité glucidique du repas (histogramme jaune) afin de permettre la liberté alimentaire.
L’insulinothérapie fonctionnelle est une méthode dont le principe consiste à adapter la dose d’insuline du repas (analogue rapide) à la quantité de glucides ingérés. Elle offre l’avantage considérable d’une totale liberté alimentaire pour un bon contrôle des excursions glycémiques prandiales. Il faudra cependant rester prudent, avec des indications ciblées, notamment chez les diabétiques de type 2 obèses ou avec troubles du comportement alimentaire.
Populations particulières
L’objectif d’HbA1c peut être révisé à la hausse si le diabète est d’apparition tardive et/ou si l’espérance de vie est diminuée. Pour toutes ces raisons, l’insulinothérapie est souvent le meilleur choix. Le schéma doit être simple, une injection par jour d’un analogue lent, et si besoin une insuline rapide aux repas. Il faut éviter les insulines « premix » qui exposent à un plus grand risque d’hypoglycémie, car elles nécessitent des horaires et des quantités de glucides fixes.
Le risque d’hypoglycémie
Le risque d’hypoglycémie chez les diabétiques de type 2 est nettement plus faible que celui des diabétiques de type 1 traités par insuline. En réalité, il est quasiment similaire à celui des sulfamides. L’association à la metformine des analogues lents diminue le risque d’hypoglycémie. Les hypoglycémies sont le plus souvent modérées, bien ressenties et facilement resucrables. Le risque est limité chez les diabétiques de type 2 en raison de la persistance d’une hyperglucagonémie et d’une insulinosécrétion endogène résiduelle, et de l’existence d’une insulinorésistance périphérique.
Prise de poids
Toute amélioration de 1 point d’HbA1c s’accompagne en moyenne d’une prise de poids de 2 kg.
La prise de poids varie de 3 à 8 kg en moyenne pendant les 6 à 12 premiers mois du traitement. Elle est en corrélation avec le poids maximal avant l’insuline et l’IMC au moment de la mise à l’insuline : les patients qui ont l’IMC le plus élevé sont ceux qui prendront le moins de poids. En revanche, il est admis que ni l’HbA1c ni la dose d’insuline de départ ne jouent de rôle sur la prise de poids. Celle-ci est plus marquée dans les schémas avec multi-injections. Les mécanismes impliqués sont l’augmentation de l’apport calorique liée à la disparition de la glycosurie et à l’effet anabolisant et antilipolytique de l’insuline. Le patient qui avait perdu du poids lors du déséquilibre glycémique majeur revient de façon naturelle au moins à son poids précédant l’insulinothérapie. Il est donc nécessaire d’anticiper cette prise de poids en associant une prise en charge diététique adaptée (régime et activité physique). La metformine doit être maintenue car elle diminue les besoins en insuline et limite la prise de poids.
En conclusion
Le diabète de type 2 est une maladie chronique évolutive caractérisée par une perte progressive de la sécrétion d’insuline. En conséquence, le traitement par insuline devient indispensable à moyen terme pour l’équilibre glycémique et pour prévenir, stabiliser ou retarder la survenue des complications vasculaires du diabète. Le point essentiel des nouvelles recommandations est l’abaissement de l’objectif glycémique afin de maintenir une HbA1c au dessous de 6,5 % et la devise est « traiter plus tôt, plus vite, plus fort ».
L’insulinothérapie est souvent retardée du fait de l’appréhension du patient (et du médecin). Il convient d’en parler précocement dans la prise en charge de la maladie, ce qui facilitera son acceptation.
La mise à l’insuline d’un patient diabétique de type 2 n’est pas un signe de gravité, mais permet au contraire d’éviter la survenue des complications.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :