Publié le 30 nov 2016Lecture 5 min
Arrêt cardiaque et dissection coronaire : à propos d’un cas
T. POSPIECH*, L. AIMABLE*, P. COSTE**, H. DOUARD* *Unités Maladie coronaire - Réadaptation - Épreuves d’effort - Cardiologie du sport **Unité de Soins intensifs cardiologiques Hôpital Cardiologique du Haut-Lévêque, Pessac, CHU de Bordeaux

M. V., âgé de 30 ans, est prise en charge en unité de soins intensifs cardiologiques (USIC) pour arrêt cardio-respiratoire récupéré sur fibrillation ventriculaire.
Il n’a pas d’antécédent particulier sur le plan familial. À noter sur le plan personnel une voie accessoire postéro-septale droite bénigne (après exploration électro-physiologique) non ablatée. Il a pour facteur de risque cardiovasculaire un tabagisme actif évalué à 10 paquets/année. Il pèse 66 kg et mesure 173 cm.
Lors d’un entraînement de course à pied en vue d’un semi-marathon, il a présenté à l’effort un tableau d’ACR, massé d’emblée par des témoins, avec une période de « low-flow » estimée à 10 minutes sans « noflow ». La mise en place du défibrillateur semi-automatique par les pompiers objective un tracé en fibrillation ventriculaire réduite après 3 chocs électriques. Le patient est ensuite intubé par l’équipe du SAMU sur des critères neurologiques et transféré en USIC pour la suite de la prise en charge.
L’examen clinique initial retrouve une hémodynamique stable sans amines, une Spo2 à 100 % chez ce patient intubé-ventilé avec 70 % de FiO2. Les pupilles sont symétriques en myosis bilatéral sous sédatifs.
L’ECG initial s’inscrit en rythme sinusal, régulier à 80/min, avec un espace PR normal à 160 ms, sans aspect de préexcitation, des QRS à 90 ms avec aspect de bloc de branche droit incomplet. À noter un aspect de repolarisation précoce avec « notching » dans les dérivations latérales et inférieures chez ce sportif d’endurance.
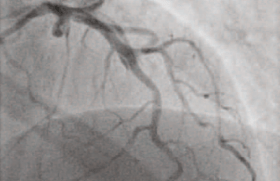
Le patient est rapidement transféré en salle de coronarographie devant un dosage de troponine positif. L’examen réalisé par voie fémorale droite retrouve un réseau globalement athéromateux avec un aspect évocateur d’un hématome de paroi de l’interventriculaire antérieure (IVA) distale (figure 1) sans retard circulatoire (flux TIMI 3). La ventriculographie retrouve une akinésie apicale limitée. La réalisation d’une imagerie endocoronaire (IVUS, intravascular ultrasound) confirme l’hématome de paroi de l’IVA distale (figure 2) ainsi que la présence d’une plaque athéromateuse excentrée de l’IVA proximale (figure 3). Aucun geste de revascularisation n’est réalisé et le patient est mis sous monothérapie antiagrégante plaquettaire et statines ainsi que sous bêtabloquants.
Figure 1. Coronarographie initiale. Aspect de dissection de l’IVA distale (flèche blanche).
Figure 2. Coronarographie initiale. Aspect en IVUS de l’hématome de paroi de l’IVA distale (flèche blanche).
Figure 3. Coronarographie initiale. Aspect en IVUS de la plaque excentrée de l’IVA proximale (flèche blanche).
L’évolution est rapidement favorable après 24 heures d’hypothermie thérapeutique. Le patient est extubé à J+2, sans séquelle neurologique. Les bêtabloquants sont diminués puis stoppés en raison d’une bradycardie sinusale importante avec échappement jonctionnel. Aucun trouble du rythme n’a été observé à la surveillance scopique.
Sur le plan biologique, le bilan initial ne retrouve pas de trouble hydro-électrolytique, pas de dysthyroïdie, le pic de troponine est à 1 5 ng/ml (normale < 0,04 ng/ml). Le bilan lipidique retrouve un LDL-C à 0,77 g/l, un HDL-C à 0,4 g/l et des triglycérides à 1,23 g/l. L’hémoglobine glyquée est normale à 5,9 %. L’échocardiographie transthoracique réalisée avant la sortie retrouve une bonne fonction systolique ventriculaire gauche avec fraction d’éjection (FEVG) autour de 70 %, un strain longitudinal global normal à -21 %, des ventricules gauche et droit de morphologie et d’épaisseur normales. Il n’y a pas de trouble cinétique résiduel, notamment apical, pas de valvulopathie significative, ni hypertension artérielle pulmonaire. Le péricarde est sec.
Sur le plan étiologique, la recherche de toxiques est négative. Il n’y a aucun élément clinique d’orientation en faveur d’une maladie du tissu élastique. Le bilan immunologique s’avère normal également. Un bilan morphologique des troncs supra-aortiques (TSA) ainsi que de l’aorte et des artères rénales et iliaques par angio-scanner ne retrouve pas de dissection sur un autre site, ni d’aspect de dysplasie fibromusculaire.
Le patient est finalement rentré à domicile au 14e jour d’hospitalisation avec de discrets troubles mnésiques résiduels, puis revu pour contrôle coronarographique 1 mois plus tard : on retrouve une nette régression angiographique et échographique (IVUS) de l’hématome (figure 4) sans aucun trouble résiduel de la cinétique ventriculaire gauche.
Figure 4. Coronarographie de contrôle à 1 mois. Nette régression de l’aspect de dissection de l’IVA distale.
Discussion et revue de la littérature
La dissection coronaire spontanée est une entité regroupant la notion d’hématome de paroi et de dissection (spontaneous coronary artery dissection ou SCAD pour les Anglo-Saxons), ces deux éléments étant manifestement liés à une physiopathologie similaire. Elle représente de 0,1 % à 4 % des syndromes coronariens aigus (SCA) tout-venant(1) et jusqu’à 8,7 % des SCA chez les femmes de moins de 50 ans(2). Le SCA en est la présentation la plus fréquente, avec 3 à 4 % d’ACR inauguraux dans une série canadienne(3).
L’étiologie est multifactorielle avec souvent une maladie artérielle sous-jacente et prédisposante : les terrains principalement décrits sont la grossesse et le post-partum, les maladies du tissu élastique (Marfan, Ehler-Danlos notamment) et les vascularites. Une récente revue de la littérature retrouvait environ 30 % de cas de SCAD en période de grossesse ou post-partum (en rapport avec des modifications hormonales conduisant à une fragilité pariétale artérielle)(4). Par ailleurs, une dysplasie fibromusculaire est retrouvée dans 70 % à 80 % des cas selon les séries (atteinte d’au moins un territoire parmi les artères rénales, iliaques et TSA en angio-scanner ou angio-IRM), la dysplasie fibro-musculaire semblant également être un facteur prédisposant de SCAD(5,6).
L’apport de l’imagerie endocoronaire, et notamment l’OCT (optical coherence tomography), a été également clairement démontré, à visée diagnostique, mais également thérapeutique(4,7,8).
Sur le plan thérapeutique, la tendance est à privilégier une stratégie conservatrice initiale, avec traitement médicamenteux associant bêtabloquants et aspirine en monothérapie. La bithérapie antiagrégante pourrait être délétère en favorisant la progression de l’hématome, mais les données restent là encore controversées. Il n’existe cependant pas à l’heure actuelle de recommandations, la majorité des données étant issues de séries rétrospectives ou de cas cliniques isolés. L’angioplastie semble quant à elle réservée aux situations de sauvetage en cas d’ischémie résiduelle (occlusion totale, sus-ST persistant) ou d’instabilité hémodynamique(4,8,9). Dans la série de la Mayo Clinic, parmi 90 patients non revascularisés initialement, seulement 10 % ont nécessité une revascularisation secondaire (douleur thoracique récidivante, extension de la dissection), et uniquement 2,3 % dans la série canadienne de Saw et coll.(3,9). L’imagerie endocoronaire est généralement contrôlée au-delà d’un mois afin de s’assurer de la résorption de l’hématome et de la cicatrisation de la dissection. Le pronostic des patients survivant à la phase aiguë est excellent, avec 94 % de patients n’ayant pas présenté d’événement indésirable à 3 ans dans l’étude d’Alfonso et coll.(11).
Enfin, une étude récente de l’équipe canadienne a démontré l’intérêt et la sûreté d’un programme de réadaptation cardiovasculaire après événement coronarien dans ce type de population(12).
En pratique
Cette observation permet de rappeler et de faire le point sur la dissection coronaire spontanée, étiologie moins classique mais probablement sous-estimée de SCA.
Elle doit tout particulièrement être envisagée chez les sujets jeunes, a fortiori les femmes.
Le lien avec l’effort n’est pas clairement élucidé, mais ce dernier, par les modifications physiologiques qu’il génère (contraintes mécaniques, déshydratation, élévation du taux circulant de catécholamines, etc.) semble être un facteur favorisant à la phase aiguë.
L’activité physique ne doit cependant pas être définitivement proscrite, mais adaptée en fonction du terrain sousjacent.
Les registres et données futurs permettront certainement de confirmer ces éléments, notamment l’étude DISCO débutée récemment(13).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :