Insuffisance cardiaque
Publié le 01 avr 2017Lecture 5 min
Insuffisance cardiaque en oncologie - Un premier consensus d’experts de la Société européenne de cardiologie
Mathilde BAUDET, Hôpital Lariboisière, Paris ; Antenne de cardio-oncologie, hôpital Saint-Louis, Paris

La toxicité myocardique des chimiothérapies est un problème majeur en oncologie. De survenue précoce ou tardive, son incidence est variable selon le type de chimiothérapie, les doses, les associations de traitements utilisées ; elle peut aller jusqu’à 48 % pour les anthracyclines et 20 % pour les nouvelles thérapies ciblées (anticorps monoclonaux, inhibiteurs des tyrosine kinase, etc.). Avec le vieillissement de la population, les patients recevant une chimiothérapie ont de plus en plus fréquemment des facteurs de risque ou des pathologies cardiovasculaires. La survenue d’une cardiotoxicité expose non seulement les patients à un risque de développer une insuffisance cardiaque avec une morbi-mortalité accrue(1), mais aussi à un risque de devoir interrompre un traitement pourtant efficace contre le cancer.
Pour la première fois cet été, l’European Society of Cardiology (ESC) s’est positionnée sur la prise en charge des patients atteints de cancer face aux risques cardiovasculaires de leurs traitements(2). Ce premier consensus ne fait pas l’objet de recommandations formelles, les données actuelles de la littérature reposant sur des études monocentriques et manquant souvent de puissance. Mais, il propose une stratégie de prise en charge aux cardiologues amenés à suivre ces patients. Nous nous intéresserons dans cette revue à la cardiotoxicité myocardique des chimiothérapies.
Évaluation en préchimiothérapie
Déterminer le risque de cardiotoxicité
L’évaluation initiale d’un patient devant recevoir une chimiothérapie cardiotoxique a pour but de déterminer son risque de développer une cardiotoxicité aux chimiothérapies. Les différents facteurs de risque sont résumés dans la figure 1.
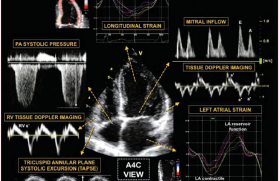
Ces recommandations proposent alors d’associer à une consultation cardiologique, la mesure d’une fraction d’éjection du ventricule gauche (FEVG) par échographie, scintigraphie ou résonnance magnétique cardiaque. Il est également introduit la possibilité d’utiliser le dosage de troponine hypersensible (troponine HS) et la mesure du strain longitudinal global afin d’optimiser la détection d’une anomalie cardiaque subclinique.
Les experts rappellent aussi l’importance d’effectuer l’évaluation initiale et la surveillance en utilisant la même technique d’imagerie et les mêmes dosages de biomarqueurs.
Figure 1. Facteurs de risque de cardiotoxicité.
Faut-il introduire un traitement préventif ?
Les résultats des études évaluant le bénéfice d’un traitement par IEC, bêtabloquants ou l’association des deux pour prévenir la survenue d’une cardiotoxicité étant controversés, ces traitements ne sont pas recommandés en prévention primaire chez les patients à faible risque de cardiotoxicité.
Cependant, ces recommandations suggèrent que pour les patients à plus haut risque (patients devant recevoir de fortes doses d’anthracyclines, présentant une cardiopathie sous-jacente ou des facteurs de risques cardiovasculaire mal contrôlés), cette association pourrait alors être proposée.
La dexrazoxane, traitement limitant la toxicité des anthracyclines sur les myocytes, ayant démontré un bénéfice pour réduire le risque de cardiotoxicité aux anthracyclines, elle est indiquée chez les patients ayant déjà reçu une dose de doxorubicine > 300 mg/m2, nécessitant une nouvelle cure d’anthracyclines. Ce traitement est en pratique peu utilisé en France.
L’activité physique, en plus d’améliorer la fatigue et la qualité de vie des patients, montre un potentiel cardioprotecteur prometteur en oncologie et un exercice physique aérobie devrait être encouragé dans cette population.
Surveillance au cours de la chimiothérapie
Détection de la cardiotoxicité
La détection d’une cardiotoxicité repose sur des outils d’imagerie cardiaque et de biomarqueurs. Les experts retiennent comme définition de la cardiotoxicité une FEVG < 50 % et ayant diminué de plus de 10 % par rapport à sa valeur en préchimiothérapie. Cette valeur de la FEVG est légèrement différente de celle proposée par l’Europan Association of Cardiovascular Imaging qui retenait une FEVG à 53 %(3).
• L’intérêt du strain et de la troponine
Une cardiotoxicité sub-clinique est définie comme une diminution du strain longitudinal global (SLG) de 15 % en valeur absolue par rapport à sa valeur en pré-chimiothérapie ou une élévation de la troponine HS supérieure à 2DS. Ces deux paramètres ont montré leur capacité à prédire la survenue d’une cardiotoxicité d’autant plus qu’ils sont utilisés en association. Si le diagnostic de cardiotoxicité est fait, une nouvelle mesure de la FEVG devra être confirmée à 3 semaines.
L’échographie cardiaque reste la méthode de choix pour la détection de la cardiotoxicité. Peu coûteuse et non irradiante, elle permet également de détecter les autres éventuelles complications des traitements anticancéreux (HTAP, valvulopathies, péricardite, etc.).
Stratégie de surveillance
Selon le type de chimiothérapies, différents schémas de suivi ont été proposés :
Chez un patient traité par anthracyclines, il est recommandé de faire une évaluation par imagerie cardiaque (avec mesure de la FEVG et si possible du SLG) et un dosage de troponine HS avant la première cure de chimiothérapie, après 240 mg/m2 puis tous les 50 mg/m2 jusqu’à la fin de la chimiothérapie.
La cardiotoxicité aux anthracyclines étant généralement de survenue tardive, une nouvelle mesure devrait donc être réalisée 6 mois après la fin de la chimiothérapie, voire 1 an et 5 ans après pour les patients ayant reçu de fortes doses d’anthracyclines ou ayant développé une cardiotoxicité.
Pour les patients sous trastuzumab, il est recommandé de faire une évaluation par imagerie cardiaque (avec mesure de la FEVG et si possible du SLG) et un dosage de troponine HS tous les 3 mois jusqu’à la fin du traitement.
Une surveillance plus rapprochée pourra être proposée chez les patients à haut risque de cardiotoxicité ou chez ceux présentant une cardiotoxicité subclinique.
Avec les inhibiteurs du VEGF, une surveillance précoce des patients à haut risque de cardiotoxicité pourrait être proposée entre les 2e et 4e semaines suivant le début du traitement.
Pour les autres chimiothérapies, le manque de données ne permet pas d’établir un schéma de suivi précis, mais une surveillance minimale avant et à la fin de la chimiothérapie semble d’emblée indiquée.
En pratique
En cas de survenue d’une cardiotoxicité avérée en cours de traitement ou à distance, l’introduction précoce d’une association par IEC/ARA2 et bêtabloquants doit être proposée au patient. Pour une FEVG ayant diminué en deçà de 40 %, le traitement repose alors sur les recommandations européennes de 2016 sur le traitement de l’insuffisance cardiaque à FEVG altérée.
L’introduction d’un traitement cardioprotecteur chez les patients avec une cardiotoxicité subclinique est moins établie. En attendant de nouvelles études, en cas de détection d’une dysfonction ventriculaire gauche subclinique, la surveillance cardiologique sera renforcée.
Concernant la poursuite du traitement anticancéreux en cas de survenue d’une cardiotoxicité en cours de chimiothérapie, les stratégies varient selon le type de chimiothérapie et la sévérité de la dysfonction cardiaque. En cas de survenue d’une cardiotoxicité aux anthracyclines, le traitement sera interrompu définitivement. Au contraire, dans le cas du trastuzumab, le traitement sera interrompu si la FEVG est < 45 % ou entre 44 et 49 % et ayant diminué de plus de 10 % par rapport à sa valeur en pré-chimiothérapie. Le traitement pourra être réintroduit une fois la FEVG > 49 % (figure 2).
La prise en charge des patients traités par une chimiothérapie cardiotoxique est ainsi un exercice difficile et exigent. Elle nécessite une expérience et des compétences, justifiant le concept d’une sous-spécialité, la cardio-oncologie. Ce premier consensus d’experts nous donne des éléments pour orga niser le parcours de soin de ces patients. On peut s’attendre dans les années à venir à voir ces recommandations évoluer avec l’arrivée de nouvelles études de plus grande ampleur mais aussi avec l’émergence constante de nouvelles thérapeutiques potentiellement cardiotoxiques.
Figure 2. Stratégie de prise en charge d’une toxicité au trastuzumab.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :