Publié le 01 avr 2017Lecture 7 min
Insuffisance cardiaque à FEVG préservée ou à FEVG intermédiaire : quésako ?
Lamia KESRI-TARTIÈRE, Service de réadaptation cardiovasculaire, hôpital Léon Bérard, Hyères
Les dernières recommandations sur l’insuffisance cardiaque (IC) de l’ESC 2016 ont accouché d’une troisième forme d’IC : l’IC à fraction d’éjection intermédiaire (ICFEi). Éléphant ou souris, cela reste à déterminer. Cette nouvelle forme se positionne comme un intermédiaire entre l’IC à fraction d’éjection réduite (ICFEr) définie par une fraction d’éjection ≤ 40 % et l’IC à fraction d’éjection préservée (ICFEp) définie par une fraction d’éjection ≥ 50 %.
Insuffisance cardiaque à FEVG intermédiaire
Les critères nécessaires à sa définition sont au nombre de trois :
- symptômes et/ou signes d’IC ;
- BNP > 35 pg/ml ou NTproBNP > 125 pg/ml ;
- anomalie échographique structurelle (HVG ♂ > 115 g/m2, ♀ > 95 g/m2 et/ou dilatation OG > 34 ml/m2) et anomalie fonctionnelle (E/E’ > 13 et E’ < 9 cm/s).
La mesure de la FEVG sépare alors l’habituelle ICFEp (> 50 %) de la nouvelle ICFEi (4050 %).
Cette classification purement arbitraire est critiquable, en raison des limites de variabilité et de reproductibilité de la mesure de la FEVG, mais également du fait de l’évolution naturelle de la FEVG dans cette zone grise de 4050 % pouvant évoluer vers l’un ou l’autre des groupes d’IC habituels. Très peu de données sont disponibles pour cette nouvelle classe qui représenterait 10 à 20 % des IC(2). Ses caractéristiques cliniques et anamnestiques semblent être intermédiaires entre ICFEp et ICFEr. Il est noté une prévalence de coronaropathie similaire aux ICFEr. Ce phénotype présente également des spécificités échographiques avec un remodelage plus excentrique pouvant représenter un stade précoce de l’ICFEr, une baisse de la contractilité et une perte de la compliance du VG(2) (figure 1).
Figure 1. Courbes pressions volumes chez ICFEp, ICFEi et ICFEr (d’après Lam CS et al.(2)).
Ces caractéristiques font envisager l’ICFEi comme une forme clinique et échographique de transition entre l’ICFEr et l’ICFEp, et non comme un nouveau type d’IC.
Insuffisance cardiaque à FEVG préservée
L’ICFEp est une nosologie complexe associant différents mécanismes physiopathologiques (à des degrés variables selon les patients), à de nombreuses comorbidités. L’ICFEp du sujet âgé, en s’affranchissant des formes particulières comme les cardiopathies hypertrophiques ou restrictives typiques, semble correspondre au profil typique rencontré par les cliniciens. Sa prévalence devrait être deux fois celle de l’ICFEr à l’horizon 2020(3).
L’importance des comorbidités
La présence de comorbidités dans l’ICFEp est un facteur aggravant la pathologie en termes de pronostic, de symptômes et donc de qualité de vie. Certaines de ces comorbidités associées, voire précédant l’ICFEp, comme l’hypertension, la consommation de tabac, le surpoids, le diabète, la BPCO, le syndrome d’apnée du sommeil ou l’insuffisance rénale chronique sont susceptibles de favoriser l’apparition d’un état proinflammatoire caractérisé par la libération de nombreuses molécules de l’inflammation. Cette inflammation pourrait participer à la détérioration structurelle et fonctionnelle du système cardiovasculaire, systémique comme pulmonaire(4,5).
Les mécanismes inflammatoires ne sont toutefois pas seuls à agir et les phénomènes de glycosylation des protéines de liaison ou l’augmentation des contenus en calcium des matrices extracellulaires sont également impliquées(6,7) (figure 2).
Figure 2. Rôle des comorbidités dans la genèse de l’ICFEp (d’après(7)).
Le couple cœur et vaisseaux dans l’ICFEp
L’étude de l’ICFEp a généralement abordé les différentes composantes structurelles et fonctionnelles du système cardiovasculaire (cœur et vaisseaux), leur interdépendance (couplage) et les liens existant entre ce système cardiovasculaire et les autres organes (comorbidités).
• Le cœur
De nombreuses études ont mis en évidence des altérations structurelles du myocarde avec principalement un remodelage concentrique, voire une hypertrophie des cardiomyocytes, une atteinte de la microcirculation coronaire, une fibrose interstitielle(8,9). Ces altérations structurelles ont pour conséquence une relaxation incomplète du myocarde, une rigidité des cardiomyocytes et donc du ventricule, des anomalies du remplissage ainsi qu’une altération de la fonction systolique intrinsèque (mouvements longitudinaux et torsions). Le caractère rigide en diastole du ventricule, en plus d’être lié aux propriétés, à la taille des cardiomyocytes et à la géométrie du ventricule, est également lié à la composition des protéines du sarcomère, aux propriétés distensibles du cytosol et des membranes et aux liaisons interfibrillaires se créant au sein de la matrice extracellulaire(10).
• Les oreillettes
Les mécanismes de remodelage du ventricule gauche touchent également l’étage auriculaire. Il est constaté une dilatation auriculaire (> 34 ml/m2) avec là encore une perte de la fonction réservoir et de la fonction contractile de l’OG telle, qu’elles peuvent être étudiées en strain(11). Cette dégradation du tissu atrial majore le risque de survenue des arythmies atriales comme la fibrillation. De par sa place entre la circulation systémique et pulmonaire, elle est également probablement impliquée dans la genèse des hypertensions pulmonaires associées à l’ICFEp(12).
• Artères systémiques
Les mécanismes de remodelage touchant le myocarde concernent également le système artériel. Celui-ci peut être séparé en deux grandes composantes ayant une structure et une fonction hémodynamique distinctes : le système artériel proximal (aorte, branches proximales) et les artères distales musculaires et artérioles.
Chez l’ICFEp, il est retrouvé une rigidification du système artériel en lien avec une augmentation du diamètre des gros vaisseaux et des modifications dans la composition des parois. La réponse tensionnelle à l’effort est exagérée, avec une augmentation explosive des résistances proximales et une inadaptation du système de vasodilatation périphérique.
À l’échelle artériolaire, il est retrouvé chez les patients ICFEp une raréfaction de la microcirculation, en particulier au niveau musculaire. Cette raréfaction vasculaire est en lien avec l’inadaptation des résistances vasculaires périphériques à l’effort, et avec la mauvaise extraction de l’oxygène par les muscles périphériques. Elle est donc en partie responsable de la gêne fonctionnelle à l’effort, caractéristique des ICFEp.
Ce phénomène de rigidification de l’ensemble du système cardiaque est associé à un couplage ventriculo-artériel défavorable (rapport des élastances télésystolique ventriculaire Ees et artérielle Ea), et cela tout particulièrement lors de l’effort ou d’un stress.
Ce phénomène est à l’origine d’une labilité tensionnelle caractéristique des sujets âgés avec ou sans ICFEp, Ea (force s’opposant à l’éjection du ventricule) se majorant plus que Ees (adaptation contractile), notamment à l’effort. Les conditions de travail du cœur sont alors défavorables du fait d’une augmentation de la post-charge(10). Toutefois, cette altération du couplage est probablement plus caricaturale sur le secteur vasculaire proximal(13), que distal.
• Artères pulmonaires
En dehors même de l’association fréquente de l’ICFEp à une pathologie pulmonaire (BPCO, emphysème, etc.), il semble exister parfois des hypertensions artérielles pulmonaires (HTAP) disproportionnées. Cette HTAP peut être définie par des pressions de remplissage VG élevées associées à un gradient transpulmonaire élevé en faveur d’une composante précapillaire s’ajoutant à celle postcapillaire(15). Ces anomalies sont elles aussi liées au tonus vasculaire et au remodelage du système artériel périphérique pulmonaire. Il existe comme au niveau systémique, une augmentation de la rigidité artérielle pulmonaire proximale, celle-ci étant plus fortement liée au pronostic. Là encore, le couplage ventriculo-artériel est susceptible d’être fortement altéré avec un risque de dysfonction ventriculaire droite d’autant plus important que le ventricule droit n’est pas adapté au travail en régime pressionnel élevé. Dans cette forme physiopathologique avec des HTAP disproportionnées, voire prédominantes, la fonction atriale gauche semble jouer un rôle clé(11,12).
Les nouveaux outils diagnostiques dans l’ICFEp
Alors que le diagnostic peut être relativement simple en phase congestive, il reste de diagnostic difficile en dehors de cette phase.
L’échographie cardiaque de repos, les peptides natriurétiques restent des éléments pivots du diagnostic, ces examens peuvent dans certains cas litigieux être complétés par une évaluation à l’effort(14) (figure 3) :
- l’échographie d’effort permet d’estimer les pressions de remplissage (E/E’ > 13) et la pression artérielle pulmonaire en stress (PAPs > 45 mmHg) et de démasquer parfois le profile habituel d’ICFEp ;
- une analyse fonctionnelle cardio-respiratoire avec mesure des échanges gazeux permet également d’améliorer la compréhension des limitations fonctionnelles (cardiaque, pulmonaire, périphériques) et d’aboutir au diagnostic positif d’ICFEp ainsi qu’aux diagnostics associés ;
- le cathétérisme droit permet d’affirmer l’élévation des pressions de remplissage et d’évaluer dans le même temps le caractère disproportionné ou pas de l’HTAP lorsque l’évaluation indirecte par échographie n’est pas concluante.
Certaines techniques d’écho-Doppler permettent de mieux appréhender les mécanismes physiopathologiques :
- l’étude de la fonction atriale au repos et à l’effort (fonction réservoir anormale en strain < 23 % et fonction pompe anormale en strain rate > -0,91 s-1 (figure 4)(11,15,16) ;
- l’étude de la fonction contractile VG et VD au repos et à l’effort(17,18).
Figure 3. Algorithme diagnostique de l’ICFEp (d’après(14)).
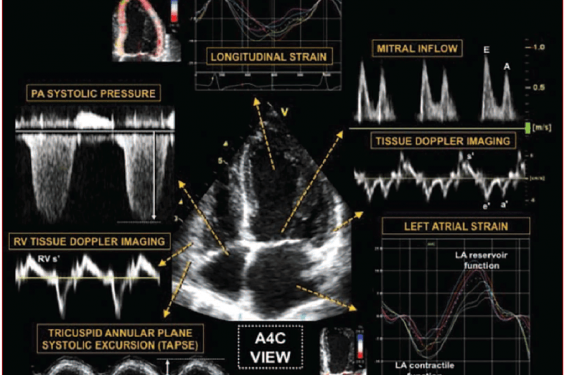
Figure 4. Analyse échocardiographique de l’ICFEp (d’après(15)).
D’autres examens comme l’IRM cardiaque pour détecter de la fibrose ou une maladie infiltrative(6), la scintigraphie myocardique au DPD-Tc99m pour rechercher une amylose à la transthyrétine sauvage dite « sénile »(19) sont également disponibles dans certains centres.
En pratique
L’ICFEp du sujet âgé reste toujours difficile à définir, même si un profil associant une rigidification du système cardiovasculaire (systémique et pulmonaire) incluant une atteinte fonctionnelle atriale et un ensemble de comorbidités interagissant sur ce même système semble maintenant bien établi.
L’ICFEi semble donc être plus « souris » qu’« éléphant », avec comme fonction principale d’extraire du groupe des ICFEp les formes de transition avec l’ICFEr. Malgré tout, cette population existe et des solutions devront être également trouvées ces patients encore plus difficilement cernables.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :