Cardiologie interventionnelle
Publié le 15 avr 2017Lecture 7 min
Dégénérescence de bioprothèse : TAVI valve-in-valve ou chirurgie redux ?
David ATTIAS et coll.*, Centre cardiologique du Nord (CCN), Saint-Denis

Cette question sur la prise en charge des dégénérescences de bioprothèse va devenir de plus en plus fréquente. En effet, les bioprothèses sont implantées chez des patients de plus en plus jeunes. Avec le vieillissement de la population, il va y avoir mécaniquement de plus en plus de patients présentant des dégénérescences de bioprothèses. Ces patients, plus âgés et avec des comorbidités, pourront être alors traités soit par TAVI valve-invalve (TVIV) soit par chirurgie cardiaque redux. Comment prendre la meilleure décision pour nos patients ?
Toujours plus de bioprothèses implantées
Depuis plusieurs années, il a été constaté dans le monde une augmentation très importante du nombre de bioprothèses implantées qui s’est faite aux dépens des prothèses mécaniques, avec une très nette accélération du processus depuis l’apparition du TAVI(1).
Plusieurs raisons peuvent expliquer ceci : la prédominance actuelle en Occident des valvulopathies dégénératives qui sont opérées à un âge plus tardif, une meilleure durabilité des bioprothèses et surtout la possibilité du TAVI valve-in-valve qui est perçu comme moins effrayant qu’une chirurgie redux chez le sujet âgé. Un autre avantage des bioprothèses et du TVIV par la suite est de pouvoir éviter la prise obligatoire d’anti-vitamine K, qui a été rapportée comme un facteur de risque de fragilité et de mortalité chez le sujet âgé.
Dégénérescence de bioprothèses
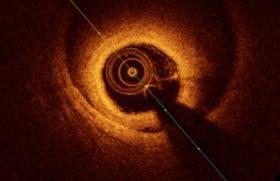
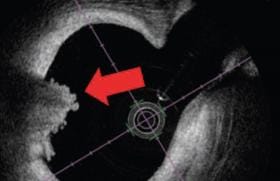
Le principal inconvénient de la bioprothèse est son risque de dégénérescence soit sur un mode régurgitant, soit sur un mode sténosant. La dégénérescence fuyante (SOR > 0,30 cm2 ou Vena Contracta > 6 mm) peut être liée à l’usure ou à une déchirure des cusps, ou encore à des séquelles d’endocardite (figure 1, A et B). La dégénérescence sténosante (gradient moyen transprothétique ≥ 40 mmHg) peut être liée à l’apparition d’un pannus, d’un thrombus ou de calcifications (figure 1, C et D).
L’équipe chirurgicale de Tours a rapporté récemment que la médiane de survie sans nécessité de réintervention sur une bioprothèse aortique Carpentier-Edwards Perimount était de 17,6 ans pour les patients de moins de 60 ans et de 19,7 ans dans l’ensemble de leur cohorte(2,3).
Néanmoins, toutes les bioprothèses ne semblent pas avoir la même durabilité. Ainsi, il a été récemment rapporté un risque de dégénérescence rapide des bioprothèses Mitroflow (Sorin), notamment pour les bioprothèses de petit calibre (19 et 21 mm), avec un impact sur la mortalité à 5 ans(4).
Figure 1. A et B : Dégénérescence fuyante de bioprothèse mitrale par perforation de l’une des cusps (flèche blanche). C et D : Dégénérescence sténosante de bioprothèse mitrale par calcification massive de la cusp latérale (flèche blanche en pointillés), avec une surface mitrale fonctionnelle à 0,62 cm2 en planimétrie ETO 3D.
Chirurgie cardiaque valvulaire aortique redux
La chirurgie cardiaque de RVAo redux a un taux de mortalité plus élevé qu’un RVAo « de première main ». La mortalité varie de 1 à 12 % selon les séries. En Europe, un registre multicentrique a récemment rapporté que la mortalité hospitalière d’un RVAo redux était de 4,1 %(5). Les principaux facteurs de risque de mortalité de la chirurgie redux de RVAo sont : une FEVG préopératoire < 30 %, un stade préopératoire NYHA III-IV, l’existence d’une endocardite infectieuse ++, l’âge > 75 ans. Bien que ce taux de mortalité soit acceptable, la morbidité peut être très lourde, notamment en cas de plaie vasculaire lors de la dissection, d’instabilité hémodynamique, d’insuffisance rénale aiguë et d’intubation prolongée.
TAVI valve-in-valve aortique
Dans le Global Valve-in-Valve Registry, 459 patients d’un âge moyen de 77 ans, à très haut risque, ont bénéficié d’un TVIV aortique : 40 % pour une dégénérescence sténosante, 30 % pour une dégénérescence fuyante et 30 % pour une dégénérescence mixte. Les petites bioprothèses (≤ 21 mm) avaient tendance à dégénérer plus souvent sur le mode sténosant, tandis que les grandes bioprothèses (≥ 25 mm) avait tendance à dégénérer sur le mode régurgitant. La mortalité à J30 était de 7,6 %, tandis que la mortalité à 1 an était de 16,8 %. Le gradient moyen post-procédure valve-in-valve était beaucoup plus augmenté en cas de TVIV sur dégénérescence sténosante que sur dégénérescence fuyante. En analyse multivariée, les principaux facteurs de risque de mortalité globale du TVIV étaient les suivants : dégénérescence sur le mode sténosant, petite taille de bioprothèses (≤ 21 mm), accès transapical pour la procédure, score STS élevé(6).
Les interrogations sur le devenir des patients ayant bénéficié d’un TVIV sont nombreuses : longévité de la bioprothèse valve-in-valve, risque potentiel de dégénérescence plus précoce notamment sur les petites bioprothèses, risque de thrombose de bioprothèse.
En cas de nouvelle dégénérescence du TVIV, des procédures de TAVI valve-in-valve-in-valve ont été rapportées(7), mais il est difficile de savoir jusqu’où ce système de poupées russes peut être bénéfique pour le patient. La procédure de TVIV nécessite une préparation en amont importante, notamment pour choisir la taille de la bioprothèse à implanter. Le scanner cardiaque et vasculaire est alors l’examen clé pour déterminer le diamètre interne de la bioprothèse, la distance anneau-coronaires, le diamètre des voies d’abord. Toute cette évaluation méticuleuse a pour but d’éviter une malposition du TVIV entraînant une fuite aortique paraprothétique importante ou une obstruction coronaire. Cette malposition de TVIV aortique survient plus fréquemment sur les bioprothèses stentless (car certaines n’ont pas de repère fluoroscopique, rendant l’implantation du TVIV moins aisée). Par ailleurs, les bioprothèses avec des cusps cousues à l’extérieur des picots (Sorin Mitroflow, Bioprothèse Saint- Jude Trifecta) sont plus à risque d’obstruction coronarienne en raison de la longueur de leurs cusps.
TVIV versus chirurgie redux aortique
Il n’y a actuellement pas d’étude prospective randomisée ayant comparé le TVIV et la chirurgie de RVAo redux. Deux études rétrospectives ont des résultats similaires : le TVIV et la chirurgie redux ont le même taux de mortalité à J30 (autour de 4 %). Néanmoins, les patients traités par TVIV étaient plus âgés et avec un EuroSCORE logistique plus élevé que les patients traités par chirurgie redux. Enfin, le gradient moyen transprothétique post-intervention était plus important chez les patients traités par TVIV(8,9).
TVIV et chirurgie redux aortique : des approches complémentaires
Le TVIV ne sera proposé qu’aux dégénérescences structurelles de bioprothèses tandis que les fuites paraprothétiques, les thromboses de bioprothèse ou les endocardites devront être traitées chirurgicalement. Le TVIV sera à proposer en première intention en cas de chirurgie cardiaque contre-indiquée ou considérée à très haut risque par la heart team. En revanche, la chirurgie redux devra être envisagée en premier lieu en cas de dégénérescence de bioprothèse sténosante de petit calibre, surtout si le patient est jeune et/ou le risque opératoire non rédhibitoire. L’existence d’un mismatch patient-prothèse après la première intervention plaide également pour une chirurgie redux qui consistera alors en un RVAo avec élargissement de l’anneau de manière à implanter une bioprothèse plus large.
TVIV versus chirurgie mitrale redux
La chirurgie mitrale redux est parfois nécessaire en cas de dégénérescence de plastie mitrale de bioprothèse mitrale ou de plastie mitrale. Cette chirurgie redux est également à risque de mortalité plus élevé (5 à 12 %), notamment en cas de comorbidités. Récemment, l’équipe de l’hôpital Bichat a rapporté une série de 7 patients traités par TVIV mitral par voie transfémorale percutanée complète, avec de très bons résultats malgré la gravité extrême de ces patients(10). Enfin, nous avons récemment rapporté le cas d’un patient à très haut risque, présentant une dégénérescence très symptomatique de bioprothèses aortique et mitrale, traité avec succès par TVIV mitral puis par TVIV aortique, à chaque fois par voie transfémorale percutanée(11).
En pratique
Le TVIV est une excellente alternative à la chirurgie valvulaire aortique redux car il permet de traiter avec succès des patients à très haut risque, de manière mini-invasive, le plus souvent sous anesthésie locale.
Bien que le TVIV permette de passer le cap opératoire, il peut entraîner par la suite un gradient moyen aortique post-TVIV élevé (surtout pour les TVIV dans les petites bioprothèses) dont l’impact au long cours est méconnu.
Chez des patients jeunes, à risque opératoire non élevé, présentant une dégénérescence sténosante d’une petite bioprothèse aortique (≤ 21 mm), une chirurgie redux doit ainsi être préférée.
Au sein d’une heart team, ces deux méthodes doivent être considérées comme complémentaires et non comme concurrentes car elles ne s’adressent pas forcément aux mêmes patients.
Enfin, il faut encourager les chirurgiens cardiaques à implanter des bioprothèses de la plus grande taille possible pour favoriser par la suite un TVIV avec le meilleur pronostic.
Figure 2. Fluoroscopie lors d’un TVIV dans une bioprothèse aortique (A), dans une bioprothèse mitrale par abord veineux transfémoral percutané (B). Fluoroscopie en fin de procédure chez un patient présentant 2 bioprothèses mitrales et aortiques dégénérées traitées par TVIV mitral puis aortique par voie percutanée transfémorale (C).
Figure 3. Intérêt majeur du scanner en post-procédure pour s’assurer de l’implantation satisfaisante du TVIV mitral (TVMI) et aortique.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :