Rythmologie et rythmo interventionnelle
Publié le 15 sep 2019Lecture 8 min
Sarcoïdose cardiaque : le point de vue du rythmologue
Maxence DUFOUR*, Cyril GOUJEAU**, ∗Hôpital d’Instruction des Armées Desgenettes, Lyon, **Centre Hospitalier de La Rochelle
La sarcoïdose est une maladie multisystémique rare dont l’étiopathogénicité exacte demeure inconnue aujourd’hui. Elle se caractérise par la présence d’un infiltrat granulomateux sans nécrose caséeuse qui intéresse le myocarde dans 5 % du temps. Les séries autopsiques révèlent que l’atteinte du muscle cardiaque peut atteindre jusqu’à 20-30 %(1). La mort subite suite à des tachyarythmies ventriculaires et à un bloc cardiaque complet représente 25 à 65 % des décès dus à la sarcoïdose cardiaque(2).
Le mode de révélation de l’atteinte cardiaque est souvent l’apparition de troubles conductifs de haut grade et des tachyarythmies supraventriculaires ou ventriculaires. Ainsi se pose régulièrement en pratique clinique chez ces patients, la question de l’implantation d’un pacemaker ou d’un défibrillateur cardiaque. Les séries prospectives sont en faveur d’une implantation large mais il n’existe malheureusement pas de critère fort pour bien stratifier le risque rythmique de ces patients ou de critère pour déterminer le meilleur moment d’implantation d’une prothèse.
La sarcoïdose cardiaque doit être évoquée chez une personne de jeune âge (< 60 ans) antérieurement considérée en bonne santé présentant des symptômes cardiaques tels que des troubles conductifs de haut grade associés ou non à des arythmies supra-ventriculaires ou ventriculaires.
Exemple d’un cas
Un homme de 46 ans, livreur de profession, en bon état général, actif sans antécédents médicochirurgicaux personnel ou familial est admis aux urgences cardiologiques à la suite de la mise en évidence d’une bradycardie auscultatoire. À l’interrogatoire, il allègue également une asthénie depuis deux mois et une dyspnée invalidante NYHA II. Cliniquement, l’hémodynamique est stable. Il est apyrétique. On retrouve de discrets signes de décompensation cardiaque gauche avec des crépitants des bases. L’électrocardiogramme s’inscrit en bloc atrio-ventriculaire (BAV) complet paroxystique avec rythme jonctionnel d’échappement intermittent à 45 battements par minute sans troubles de la repolarisation et sans argument pour une canalopathie (figure 1).
Figure 1. ECG : bloc atrio-ventriculaire complet paroxystique, salves de tachycardie ventriculaire non soutenues.
Le bilan biologique retrouve un ionogramme sanguin en particulier une kaliémie (3,9 mmol/l) et une calcémie (2,2 mmol/l) normales. La fonction rénale est préservée avec une créatinémie à 84 μmol/l. Un cycle de troponinémie est négatif. La CRP est normale.
L’échocardiographie transthoracique n’apporte aucun argument pour une cardiopathie sous-jacente. La fonction systolique droite et gauche est conservée sans trouble de la cinétique. Il n’y a pas de valvulopathie mitro-aortique significative. Étant peu probable que le patient soit porteur d’un BAV congénital asymptomatique depuis 46 ans, un bilan exhaustif est mené.
Il existe 3 grandes étiologies à évoquer devant ce tableau clinique de l’adulte jeune avec trouble conductif de haut grade qu’était la maladie de Lyme, la laminopathie et la sarcoïdose cardiaque.
• La première hypothèse est écartée à l’interrogatoire, par l’absence de notion érythème cutané migrant et de situation favorisante de piqûres de tiques. La sérologie ainsi que la PCR Lyme étaient négatives.
• La deuxième hypothèse à mentionner est la laminopathie. Il s’agit d’un groupe d’affections génétiques à transmission principalement autosomique dominante en rapport avec une mutation du gène des lamines A et C, des protéines ubiquitaires de la membrane nucléaire. Ses deux présentations cliniques les plus fréquents sont une cardiomyopathie dilatée avec troubles conductifs et irrritabilité ventriculaire sévère ou l’association de cette même cardiomyopathie à une myopathie, le plus souvent une dystrophie musculaire d’Emery Dreifuss. L’atteinte cardiaque conditionne le pronostic vital, avec un risque de mort subite rythmique très élevé chez l’adulte jeune. Cette possibilité n’est pas retenue chez notre patient devant l’absence d’atteinte familiale et de dysfonction VG. Dans le doute un conseil génétique auprès d’un centre de référence doit être réalisé.
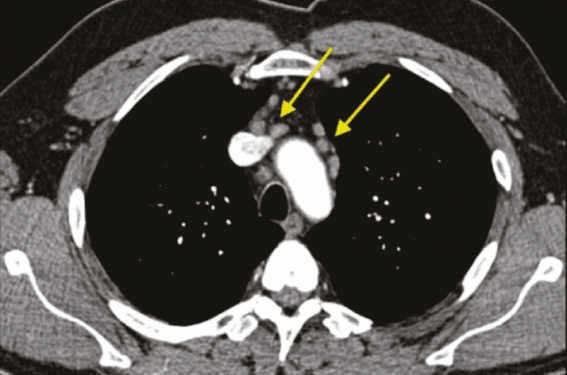
Pour étayer la dernière hypothèse un scanner thoraco-abdomino- pelvien avec injection de produit de contraste est effectué. Celui-ci objective un aspect tomodensitométrique compatible avec une sarcoïdose pulmonaire et ganglionnaire, le diagnostic différentiel étant une mycobactériose typique ou atypique (figure 2). L’IRM cardiaque retrouve une fraction d’éjection ventriculaire gauche normale, une épaisseur du myocarde normale, une absence de trouble de la cinétique segmentaire gauche et droite et une absence de masse ou thrombus cardiaque détectée. Les séquences de rehaussement tardif mettent en évidence 3 prises de contrastes étendus mésomyocardiques au niveau de la jonction ventricule droit et gauche (figure 3). Les autres faisceaux d’argument orientant vers ce diagnostic sont une alvéolite avec une inversion du rapport CD4/CD8 sur le lavage bronchio-alvéolaire. L’enzyme de conversion est normale. Le diagnostic de certitude est finalement porté par l’histologie sur biopsie transbronchique retrouvant un granulome giganto-cellulaire épithélioïde sans nécrose caséeuse.
Figure 2. TDM thoracique, temps artériel : sarcoïdose avec atteinte pulmonaire. Flèches jaunes : ganglions médiastinaux.
Figure 3. IRM cardiaque, séquence de rehaussement tardif. Flèche jaune : prise de contraste au sein du septum basal.
La surveillance télémétrique met en évidence de nombreuses salves de tachycardies ventriculaires soutenues de plusieurs complexes non ressenties par le patient. La décision est alors prise d’implanter un défibrillateur cardiaque double chambre en sous-pectoral par voie sousclavière gauche. Une corticothérapie a également été associée à de fortes doses initiales de 5 mg/kg avec un traitement immunosuppresseur par cyclophosphamide permettant une évolution rapidement favorable.
À la consultation de suivi rythmologique à trois mois post-implantation, le patient a récupéré de son bloc atrio-ventriculaire complet mais présente encore dans les mémoires des salves d’extrasystolies ventriculaires.
Discussion
Le diagnostic et le screening
Cette observation permet de souligner l’importance d’évoquer le diagnostic de sarcoïdose cardiaque dans le cadre des troubles de la conduction ou de troubles du rythme chez l’adulte jeune(3). L’évaluation initiale de la sarcoïdose pulmonaire comprend radiographie thoracique, scanner thoracique, épreuves fonctionnelles respiratoires et dosage de l’enzyme de conversion. La recherche de l’atteinte cardiaque est difficile et doit être guidée par un faisceau d’arguments clinico-biologiques et paracliniques.
En première intention on effectuera un interrogatoire (histoire de palpitations, syncope inexpliquée, lipothymie), un électrocardiogramme, une surveillance télémétrique, une échocardiographie transthoracique. D’autres examens comme l’exploration électrophysiologique, l’IRM cardiaque ou le PET-scanner ne sont utiles que chez des patients sélectionnés pour guider et monitorer la prise en charge.
La confirmation diagnostique est anatomopathologique par biopsie d’une lésion accessible par exemple pulmonaire ou ganglionnaire et peut parfois passer par une biopsie endomyocardique. Les critères de diagnostic de certitude ont été revus et publiés à l’occasion d’une conférence de consensus d’experts dans l’Heart Rhythm Society (HRS) en 2014(4).
Les manifestations cardiaques de la sarcoïdose sont maintenant bien connues avec des troubles conductifs intraventriculaires (bloc de branche complet 12-61 %), atrio-venticulaires (bloc complet 26-62 %), arythmie supraventriculaire (19- 32 %), tachycardie ventriculaire (23-50 %), mort subite (12-65 %) et insuffisance cardiaque (10- 30 %)(5). Le risque rythmique est dû à l’infiltrat granulomateux qui touche les trois tuniques du cœur mais préférentiellement le myocarde, en particulier le septum et la paroi libre du ventricule gauche. Le ventricule droit et les oreillettes sont respectivement moins touchés. Les voies de conduction sont lésées dans 40 % des cas(6).
Les thérapeutiques médicamenteuses
Le traitement repose essentiellement sur les glucocorticoïdes fortes doses et les traitements immunosuppresseurs tels que le méthotrexate, ciclosporine, cyclophosphamide sont des alternatives dans les sarcoïdoses corticorésistantes mais leurs efficacités sont moins bien étudiées(5).
Les corticoïdes améliorent la mortalité et permettent une disparition des troubles conductifs. En effet, une métaanalyse(7) retrouve une régression du bloc atrio-ventriculaire dans 47,7 % (n = 27/57 patients) des cas. Le bloc ne régressait jamais chez les patients (n = 16) non traités. En revanche le délai de régression n’est pas prédictible et peut aller de quelques jours à quelques mois.
Prise en charge rythmologique
Chez les patients symptomatiques, la stimulation est indiquée initialement par sonde d’entraînement électrosystolique puis dispositif intracardiaque définitif. Le problème peut donc se poser en pratique chez les patients asymptomatiques. La tentation pourrait être d’attendre la fin de traitement pour décider d’implanter un stimulateur cardiaque en l’absence de régression des troubles conductifs. Il n’existe pas d’essai randomisé prospectif dans cette pathologie, les recommandations reposent donc sur des données observationnelles. Les recommandations américaines préconisent l’implantation d’un pacemaker définitif, s’il existe un bloc de conduction même si les troubles conductifs sont réversibles (classe IIA).
En revanche, la corticothérapie n’a pas prouvé son efficacité sur les arythmies atriales ou ventriculaires(8). Le risque rythmique persiste au cours du temps et l’infiltrat granulomateux est responsable de cicatrices qui sont le lit des troubles du rythme. Le traitement repose en première intention alors sur les médicaments tels que les bêtabloquants et l’amiodarone. Les antiarythmiques de classe I sont contreindiqués. L’ablation de FA et de TV peut être également utile mais souvent avec des procédures complexes et difficiles(9).
Chez tous les patients éligibles à l’implantation d’un stimulateur cardiaque doit se poser la question du défibrillateur cardiaque en prévention primaire ou secondaire (encadré).
Dans la littérature, il existe 2 grandes séries prospectives ayant étudié sarcoïdose cardiaque et implantation de défibrillateur cardiaque. Schuller et coll. ont publié une série de 112 patients(11) et Betensky et coll. une série de 45 patients(12). La majorité des patients (62-74 %) ont été implantés en prévention primaire avec une fraction d’éjection altérée inférieure à 45 %. Le taux de thérapie appropriée allait de 8,6 à 15 % ce qui est bien supérieur à ce qui est vu dans les essais sur le défibrillateur cardiaque implantable tels que l’essai SCD-HeFT (Sudden Cardiac Death In Heart Failure Trial) où le taux d’intervention était de 5,1 % par an(13).
Les caractéristiques de ces patients étaient les suivantes : une altération de la fonction systolique, histoire de syncope, sexe masculin et présence d’une stimulation cardiaque. Des chocs inappropriés étaient retrouvés chez 13-24 % des patients. Les principales raisons responsables de ces chocs inappropriés étaient la présence de fibrillation atriale, tachycardie ventriculaire non soutenues, tachycardie sinusale, surdétection et fracture de sonde(14).
En pratique
La sarcoïdose cardiaque reste une pathologie rare et doit être évoquée chez le patient jeune présentant une association de troubles conductifs et d’arythmie ventriculaire.
Le traitement doit être discuté au cas par cas au sein d’une « Heart Team Cardiomyopathie » en lien avec un médecin interniste ou pneumologue. Il faut discuter à chaque fois l’implantation de dispositif cardiaque tel qu’un pacemaker ou un défibrillateur car le risque de mort subite augmente sans traitement au cours du temps.
D’un point de vue rythmologique, les études prospectives prouvent un taux de thérapies élevées qu’elles soient appropriées ou non et semblent en faveur d’une démarche agressive et d’implantation large de prothèses.
Il n’existe malheureusement pas de critère fort de stratification pour prédire le délai de régression des troubles conductifs ou le risque de mort subite mais pourrait être mieux défini dans le futur avec l’IRM et les explorations électrophysiologiques.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :