Rythmologie et rythmo interventionnelle
Publié le 16 nov 2004Lecture 4 min
Ablation de la fibrillation auriculaire : où en est-on ?
A. PISAPIA , J. FAURE , A. FERRACCI et M. BREMONDY, hôpital Saint-Joseph, Marseille

La fibrillation auriculaire (FA) est l’arythmie la plus fréquente. Son incidence augmente avec l’âge : de 0,1 % chez les sujets de moins de 55 ans, elle peut atteindre 9 % chez les sujets de 80 ans ou plus. Le nombre de patients en fibrillation auriculaire pourrait être multiplié par 2,5 d’ici à 2050.
Électrophysiologie de la fibrillation auriculaire
L’hypothèse de Moe, confirmée par les travaux d’Allessie, stipule que la FA soutenue nécessite la présence de plusieurs vaguelettes (rotor) dans l’oreillette, 6 au moins. Une vaguelette mère ou plusieurs vaguelettes permettent le maintien de l’arythmie. La différence entre la FA paroxystique et la FA chronique réside dans la fréquence et la stabilité de ces circuits. Quand la vaguelette mère est plus stable et sa fréquence plus élevée, en raison du remodelage électrophysiologique et anatomique de l’oreillette gauche, le cadre de la fibrillation auriculaire chronique est installé.
Des foyers situés le plus souvent dans les veines pulmonaires entraînent des décharges dans l’oreillette gauche et peuvent rencontrer un tissu avec des périodes réfractaires inhomogènes. Ils constituent le trigger dans de nombreux cas de FA.
Ablation de la fibrillation auriculaire
Le principe de l’ablation par radiofréquence vise à traiter :
- soit le trigger, en détruisant les foyers situés dans les veines pulmonaires et éventuellement dans l’oreillette gauche ;
- soit le substrat, en créant des lignes d’ablation dans les oreillettes.
Ablation du trigger
Cette technique, proposée par Haïssaguerre, consiste à détruire les foyers situés dans les veines pulmonaires après repérage de potentiels spécifiques à l’aide d’un cathéter Lasso. Un taux de 70 % de rythme sinusal est obtenu par cette méthode sur un suivi de 1 an. Les inconvénients sont liés à deux problèmes essentiellement :
- le risque de sténose des veines pulmonaires ;
- le pourcentage de récidives, entre 40 et 50 % à 6 mois, nécessitant la réalisation d’une deuxième séance d’ablation.
Ablation du substrat
Ce sont les chirurgiens qui ont proposé, les premiers, un traitement radical de la FA. Cox a créé des lésions chirurgicales dans les deux oreillettes et obtenu un taux de rythme sinusal de 80 %. À nouveau M. Haïssaguerre et ses collaborateurs ont reproduit par le cathéter les lésions chirurgicales du Maze.
Ablation limitée à l’OD
Dans un premier temps, l’ablation a été limitée à l’oreillette droite. Les résultats ont été décevants — 13 % de rythme sinusal à 1 an, sans traitement antiarythmique — ont conduit rapidement à l’abandon des lignes d’ablation dans l’oreillette droite pour les réaliser dans l’oreillette gauche avec un taux de succès de 57 % sans traitement antiarythmique.
Des cartographies peropératoires, réalisées en cours de chirurgie pour la valve mitrale, ont montré qu’en cas de FA, l’activité la plus rapide était autour des veines pulmonaires et du mur postérieur de l’oreillette gauche. L’application des lésions de radiofréquence autour des veines pulmonaires lors de la chirurgie mitrale permet la persistance de rythme sinusal dans plus de 80 % des cas.
Double ablation par cathéter
Paponne a ensuite proposé une nouvelle approche par le cathéter :
- création de lignes d’ablation autour des veines pulmonaires ;
- une ligne d’ablation supplémentaire est réalisée entre la veine pulmonaire inférieure gauche et l’anneau mitral.
Cette technique est réalisée à l’aide d’un système de cartographie 3D, le système Carto de Biosense-Webster.
Deux séries ont été publiées :
- 26 patients ; 12 FA permanentes avec un suivi de 9 ± 3 mois : 85 % en rythme sinusal ;
- 251 patients ; 72 FA permanentes avec un suivi de 10,4 ± 4,5 mois : 85 % en rythme sinusal pour la FA paroxystique , 62 % en rythme sinusal pour la FA permanente.
Notre expérience personnelle comporte 121 patients d’âge moyen 53,7 ans :
- 71 FA paroxystiques ;
- 20 FA persistantes ;
- 30 FA chroniques.
À 6 mois 80 patients ont été analysés :
- 48 FA paroxystiques : 93 % de rythme sinusal, 11 % de traitement antiarythmique ;
- 16 FA persistantes : 80 % en rythme sinusal, 75 % de traitement antiarythmique ;
- 16 FA chroniques : 56 % en rythme sinusal, 77 % de traitement antiarythmique.
Avantages et inconvénients des deux techniques
Cible électrophysiologique
Avantages : avec cette technique précise, l’énergie est délivrée sur l’activité la plus précoce ; les lésions sont moins étendues.
Difficultés :
- variabilité de l’anatomie des veines pulmonaires ;
- risque de sténose des veines pulmonaires ;
- recherche de foyers dans l’OG nécessaire ;
- pourcentage de récidives élevé nécessitant une deuxième séance.
Cible anatomie
Avantages : segmentation de l’OG ; ablation de foyers autour des veines pulmonaires ; pas de sténose des veines pulmonaires.
Difficultés :
- variabilité de l’anatomie des veines pulmonaires ;
- lésions plus étendues ;
- difficulté de la ligne entre la veine supérieure gauche et l’inférieure sur la crête proche de l’insertion de l’auricule gauche.
Conclusion
L’ablation de la fibrillation auriculaire est une technique applicable et efficace, et cela est valable pour les deux techniques existantes. La méthode anatomique, moins précise, permet cependant de traiter la fibrillation auriculaire chronique par la segmentation de l’OG.
Elle ne comporte pas, en outre, le risque de sténose des veines pulmonaires.
L’utilisation de l’une ou l’autre méthode, en fonction du type de fibrillation auriculaire, de la taille de l’OG ou de la pathologie sous-jacente, est actuellement une alternative séduisante dans le traitement de la fibrillation auriculaire.
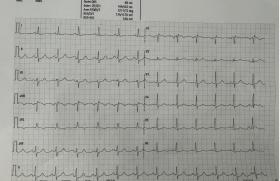
Figure 1. Potentiels de veine pulmonaire ; en 1-2, il est difficile de séparer le potentiel veineux du potentiel auriculaire.
Figure 2. Après un tir en 1-2, le potentiel veineux est retardé.
Figure 3. En fin de procédure, seul persiste le potentiel auriculaire.
Figure 4. Sténose serrée d’une veine pulmonaire.
Figures 5 et 6. Exemple de lignes autour des veines pulmonaires et entre la veine inférieure gauche et l’anneau mitral.
Figure 7. Validation des lignes par une cartographie en amplitude.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :