Rythmologie et rythmo interventionnelle
Publié le 02 fév 2005Lecture 7 min
L'exclusion percutanée de l'auricule gauche - Une nouvelle approche non pharmacologique de la prévention des accidents vasculaires cérébraux liés à la fibrillation auriculaire
A. CACHIER, D. HIMBERT, E. BROCHET et A. VAHANIAN, hôpital Bichat, Paris
La FA est la première cause cardiaque d’AVC chez les sujets âgés, le traitement anticoagulant permettant une réduction de risque globale de 60 %. Chez certains patients pour lesquels le rapport bénéfice/risque des AVK apparaît défavorable, une nouvelle alternative pointe son nez : l’exclusion percutanée de l’auricule gauche.
Fibrillation auriculaire et accidents vasculaires cérébraux
La fibrillation auriculaire (FA) est un problème majeur de santé publique en raison de sa fréquence, de la gravité de ses complications et de leur coût. C’est l’arythmie soutenue la plus fréquente, car elle concerne 0,4 % de la population générale. Sa prévalence augmente avec l’âge et atteint 10 % chez les sujets âgés de plus de 80 ans.
L’essentiel des coûts induits par la FA est lié aux hospitalisations, en particulier à l’occasion d’accidents vasculaires cérébraux (AVC). La FA est la première cause cardiaque d’AVC chez les sujets âgés : environ 15 % de l’ensemble de ces accidents lui sont attribués, soit approximativement 15 000 par an en France. Ce risque thromboembolique cérébral varie en fonction des facteurs associés à la FA. Toutes les séries s’accordent pour identifier cinq principaux facteurs de risque cliniques :
• un antécédent thrombo-embolique (AVC ou accident ischémique transitoire),
• une dysfonction ventriculaire gauche ou une insuffisance cardiaque,
• une valvulopathie (surtout le rétrécissement mitral),
• une hypertension artérielle,
• l’âge > 75 ans.
Certains y ajoutent le sexe féminin et le diabète.
D’autres facteurs ou marqueurs de risque sont identifiés par l’échocardiographie :
• dilatation de l’oreillette et/ou de l’auricule gauches,
• contraste spontané ou thrombus auriculaire,
• basses vélocités auriculaires gauches,
• dysfonction ventriculaire gauche moyenne ou importante,
• athérome aortique.
Le traitement anticoagulant par antivitamines K et ses alternatives
Tous les grands essais cliniques ont montré que le traitement préventif de référence des complications thromboemboliques cérébrales de la FA est le traitement anticoagulant par antivitamines K (AVK), permettant une réduction de risque globale de 60 %. Mais en pratique, c’est souvent chez les patients pour lesquels l’indication est la plus formelle (sujets âgés hypertendus, etc.) que le risque et les inconvénients du traitement sont aussi les plus grands, en raison de la présence de comorbidités, de pathologies hémorragiques concomitantes, de chutes, de troubles cognitifs, etc. Par ailleurs, le traitement par AVK au long cours est souvent mal surveillé, comme en témoigne la fréquence des INR en dehors de la zone thérapeutique (2 à 3).
Dans ces situations, où le rapport bénéfice/risque du traitement anticoagulant paraît défavorable, les alternatives thérapeutiques actuelles sont pauvres :
• l’aspirine, qui réduit le risque d’AVC d’environ 20 %, ne doit être proposée qu’aux sujets jeunes à faible risque thrombo-embolique ;
• l’association aspirine + clopidogrel est en cours d’évaluation chez les patients en FA à haut risque cardio-vasculaire, dans le cadre de l’étude ACTIVE (Atrial fibrillation Clopidogrel Trial with Irbesartan for prevention of Vascular Events), mais les résultats ne sont attendus que pour 2006 ;
• les résultats obtenus dans la FA non valvulaire avec le ximelagatran, inhibiteur direct de la thrombine (étude SPORTIF [Stroke Prevention using an ORal Thrombin Inhibitor in atrial Fibrillation]), sont encourageants : ils occasionnent moins de saignements que la warfarine et ne nécessitent pas de surveillance biologique, au prix d’une cytolyse hépatique plus fréquente. Cependant, cette molécule n’est pas disponible actuellement ;
• l’ablation endocavitaire de la FA est, avec la chirurgie, son seul traitement curatif, mais il s’agit d’une technique encore réservée à quelques centres peu nombreux, dont l’efficacité reste médiocre dans la FA chronique, avec un risque de complications immédiates ou secondaires non négligeable.
Exclusion percutanée de l’auricule gauche : l’étude PLAATO
Rationnel
L’hypothèse de départ est que la très grande majorité (90 %) des thrombi d’origine cardiaque responsables des AVC liés à la FA se forment dans l’auricule gauche, en raison de son anatomie (forme, trabéculations) ; par ailleurs, l’exclusion chirurgicale de l’auricule gauche a montré son utilité chez certains patients opérés d’une valvulopathie mitrale.
Une intervention d’exclusion percutanée de l’auricule gauche par cathéter a été mise au point et est actuellement évaluée dans le cadre de l’étude PLAATO (Percutaneous Left Atrial Appendage Transcatheter Occlusion).
Les candidats potentiels à cette intervention sont, schématiquement, tous les patients en FA chronique ayant à la fois une indication formelle du traitement AVK et une contre-indication à ce traitement en raison d’un risque hémorragique prohibitif ou l’impossibilité de surveillance correcte.
À titre d’exemple, les patients en ayant bénéficié dans notre centre avaient tous :
• un antécédent d’AVC ischémique rapporté à la FA ;
• une contre-indication absolue au traitement AVK, représentée par un alcoolisme chronique incompatible avec l’observance et la surveillance du traitement, un hématome du psoas avec séquelles motrices invalidantes, des traumatismes crâniens à répétition en rapport avec une hémianopsie latérale homonyme séquellaire de l’AVC, ou encore un AVC hémorragique sous AVK (tableaux 1 et 2).
Cette étude prospective multicentrique non randomisée doit inclure 150 patients dans 20 à 25 sites en Europe et en Amérique du Nord. Le suivi prévu est de 2 ans.
L’objectif primaire est de déterminer la sécurité et l’efficacité du dispositif dans la prévention des AVC chez les sujets en FA à haut risque thrombo-embolique. Les critères de jugement sont cliniques et échographiques (tableau 3).
Déroulement de l’intervention
L’implant PLAATO est constitué d’une armature métallique en nitinol comportant trois rangées de points d’ancrage, recouverte d’une membrane occlusive (figure 1).
Figure 1. Prothèse d’exclusion percutanée de l’auricule gauche. A. En position ouverte. B. Déployée en bonne position dans l’auricule gauche.
L’intervention est systématiquement précédée d’une évaluation anatomique précise de l’auricule gauche par échographie transœsophagienne (ETO) et, si possible, tomodensitométrie multicoupes, de façon à déterminer sa forme, ses dimensions, et confirmer l’absence de thrombose auriculaire. Elle se déroule sous anesthésie générale et contrôle ETO permanent.
Elle comporte les phases suivantes :
• abord veineux fémoral et cathétérisme transseptal, selon la technique habituelle ;
• franchissement du septum interauriculaire par une gaine transseptale 14 French, dirigée ensuite vers l’ostium de l’auricule gauche (figures 2 et 3) ;
• détermination angiographique et par ETO simultanée du diamètre précis de l’auricule pour le choix de la taille de la prothèse (figure 4). Le diamètre de l’implant doit excéder de 20 à 50 % celui de l’auricule. Les tailles actuellement disponibles varient de 15 à 32 mm ;
• avancée de l’implant refermé à travers la gaine transseptale jusqu’à l’entrée de l’auricule, puis retrait de la gaine de façon à le libérer et le positionner correctement dans l’auricule ;
• ouverture de la prothèse lorsque la position paraît correcte (figure 5).
Figure 2. Progression de la gaine transseptale vers l’auricule gauche, guidée par son repérage angiographique (injection de contraste par une sonde pigtail 4F).
Figure 3. Gaine transseptale en place à l’ostium de l’auricule gauche.
Figure 4. Détermination angiographique du diamètre de l’auricule gauche pour le choix de la taille de la prothèse.
Figure 5. Ouverture de la prothèse dans l’auricule gauche.
Avant son largage, cinq conditions doivent être vérifiées pour éliminer tout risque de migration de la prothèse et assurer l’efficacité de l’exclusion auriculaire :
• compression de la prothèse (diamètre en position ouverte réduit de 20 à 50 % par rapport au diamètre théorique) ;
• localisation correcte, sans protrusion de l’implant dans l’oreillette gauche ;
• apposition satisfaisante de la prothèse, avec ancrage de deux rangées de picots à la paroi ;
• étanchéité du dispositif, évaluée par l’absence de flux de part et d’autre et, à l’angiographie en ETO, par l’absence de flux de lavage et de vidange de l’auricule lors des injections de contraste par les orifices proximaux et distaux du cathéter (figure 6) ;
• stabilité, évaluée en exerçant des mouvements de traction doux du dispositif, qui doivent mobiliser simultanément l’implant et l’auricule, sans mouvement de migration ni de rotation de l’implant.
Figure 6. Vérification de l’absence de vidange de l’auricule gauche par l’injection de contraste par l’orifice distal du cathéter.
Tant que ces cinq points ne sont pas assurés, la prothèse ne doit pas être larguée et peut être refermée et repositionnée.
Après son largage, un dernier contrôle angiographique confirme sa bonne position et l’étanchéité de la fermeture de l’auricule (figures 7 et 8).
L’intervention, qui dure en moyenne 60 à 90 minutes, est relativement difficile et doit être réalisée dans des centres ayant une bonne expérience du cathétérisme transseptal, afin de limiter le risque d’hémopéricarde.
Figure 7. Largage de la prothèse.
Figure 8. Contrôle angiographique final confirmant la bonne position de la prothèse et son étanchéité.
Suivi
L’association aspirine + clopidogrel doit être débutée au moins la veille de l’intervention (avec une dose de charge de 300 mg pour le clopidogrel) et poursuivie pendant 6 mois au terme desquels seule l’aspirine sera maintenue au long cours.
La surveillance des patients, immédiatement après l’intervention, est clinique, échographique (figure 9), radiologique (radiographie thoracique [figure 10]) et on effectue éventuellement un scanner cardiaque (figure 11).
Figure 9. Contrôle de l’échographie transœsophagienne après implantation de la prothèse auriculaire gauche.
Figure 10. Radiographie du thorax après implantation de la prothèse auriculaire gauche.
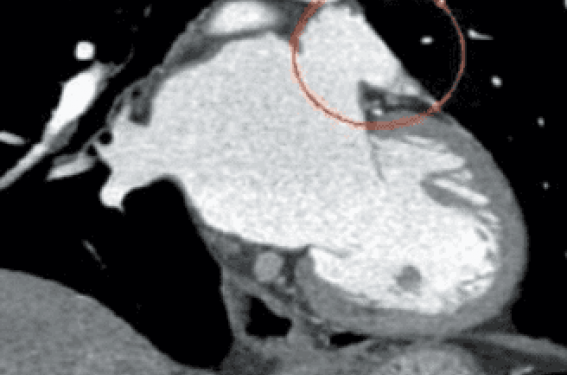
Figure 11. Scanner cardiaque. A. Avant implantation. B. Après implantation de la prothèse auriculaire gauche.
Une échographie trans-œsophagienne est réalisée de façon systématique au 2e mois pour vérifier la position et l’absence de mobilité de la prothèse, l’étanchéité du dispositif et l’absence de retentissement sur la circulation veineuse pulmonaire.
En conclusion
Les résultats préliminaires suggèrent que l’exclusion percutanée de l’auricule gauche assure une réduction du risque thromboembolique lié à la FA de l’ordre de 60 % (tableau 4). Bien qu’ils nécessitent confirmation, ces résultats sont suffisamment encourageants pour la proposer largement, dans le cadre de l’étude PLAATO, aux patients relevant d’une indication théorique du traitement AVK mais ayant aussi une contre-indication formelle à son utilisation.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :