Technologies
Publié le 30 sep 2016Lecture 6 min
Endoprothèse coronaire biorésorbable DESolve® au novolimus - Résultats et perspectives
M. ANGIOI, J. LEMOINE, J.-P. SIMON, M. AMOR, C. BRETON, Centre Cardiovasculaire de l’Est, Clinique Louis Pasteur, Essey-lès-Nancy.
La survenue d’événements indésirables tardifs après implantation d’une endoprothèse coronaire active est actuellement reliée aux phénomènes inflammatoires chroniques intrapariétaux potentiellement générés par la présence permanente de la prothèse (alliage métallique et/ou polymère) sur le long terme. Nous assistons donc actuellement au développement de nouvelles générations d’endoprothèses coronaires : les endoprothèses coronaires (ou scaffold) totalement biorésorbables qui doivent donc théoriquement résoudre ce problème. Ces scaffolds doivent par ailleurs avoir des propriétés biomécaniques leur permettant de jouer leur rôle de support et donc avoir un temps de résorption ni trop court, ni trop long avec un contrôle de la diffusion de drogue qui soit en phase avec les phénomènes de cicatrisation vasculaire initiaux.
Deux types de scaffolds sont actuellement développés en polymère ou en métal biorésorbable.
Le seul scaffold à polymère biorésorbable (poly-L-lactic acid ou PLLA) avec un dossier de remboursement LPPR en cours est l’Absorb™ à l’évérolimus (Abbott Vasculaire).
La société Elixir® a également développé un scaffold en PLLA au novolimus, le DESolve® (figure 1), qui est marqué CE et distribué par la société HEXACATH, donc disponible en France.
Figure 1. Design du scaffold DESolve®.
Le scaffold
Il s’agit d’une prothèse en PLLA avec des mailles d’une épaisseur de 150 μm avec un design type « in phase hoops with straight links », pourvue de marqueurs radio opaques aux extrémités. Le coating qui contient le novolimus est également un dérivé d’acide polylactique. La résorption du polymère du coating de surface est de 6 à 9 mois et celui du scaffold de 1 à 2 ans. Le scaffold doit être impérativement conservé entre 0 et 8 °C et il est disponible dans des tailles allant de 2,5 à 4,0 mm (par 1/4 de taille) avec des longueurs de 14, 18, 23 et 28 mm.
Les études
Les études à notre disposition sont peu nombreuses mais mettent en évidence le potentiel de ce scaffold. Il a été étudié sur le plan biomécanique et clinique avec un suivi de cohorte sur 3 ans comprenant des examens IVUS et OCT sériés. Des registres sont par ailleurs également en cours, en particulier le registre X-Pand(1) qui doit inclure 2 000 patients.
La grosse différence entre les stents en alliage et les scaffolds polymériques tient à leurs propriétés biomécaniques qui font que ces derniers sont plus fragiles. Nous disposons d’une étude sur banc de J. Ormiston qui a été publiée dans EuroIntervention(2), et qui compare DESolve®, Absorb™ et Xpedition ™. Le profil des 2 scaffolds est bien entendu moins bon que celui de l’Xpedition™.
Les 3 stents subissent un phénomène de recoil après leur pose mais on observe une auto-correction pour le DESolve® avec un retour à son diamètre initial dans l’heure qui suit. En intraprothétique, les seuils de surdilatation et de pression d’inflation pour l’apparition de fracture pour des prothèses de 3 mm étaient de 3,8 mm à 20 atm pour l’Absorb™, de 5 mm à 20 atm pour le DESolve® et aucune fracture n’a été constatée pour l’Xpedition™.
En ce qui concerne l’ouverture des mailles avec un ballon non compliant de 3 mm, le seuil de sécurité était à 10 atm pour l’Absorb™ alors qu’aucune fracture n’était constatée jusqu’à 22 atm pour le DESolve® et l’Xpedition™. Enfin pour les mini-kissings avec 2 ballons de 3 mm le seuil était à 5 atm pour l’Absorb™ alors qu’aucune fracture n’était constatée pour les 2 autres prothèses jusqu’à 20 atm. En pratique, si la résistance du DESolve® n’égale pas celle d’un stent avec une plateforme chrome/cobalt, elle semble meilleure sur banc d’essai que celle de l’Absorb™.
Sur le plan clinique on dispose des données de suivi d’une cohorte de 126 patients inclus dans l’étude DESolve® NX menée par A. Abizaid publié dans JACC Intv en 2016(3). Les critères d’inclusion dans l’essai étaient assez limitatifs avec une lésion cible par patient de moins de 12 mm dans des artères cibles de 2,75 à 3,0 mm et traitables après prédilatation par un scaffold de 3,0, 3,25 ou 3,5 mm de diamètre et de 14 ou 18 mm de long. Un traitement d’au moins 12 mois par clopidogrel et aspirine était requis après l’implantation. Le critère principal d’évaluation était la perte tardive in-scaffold à 6 mois par QCA. D’autre part, 2 sousgroupes IVUS et OCT avaient été constitués avec un examen systématique en post procédure et à 6 mois, mais en pratique ces patients ont également été suivis à 18 et 36 mois.
Sur le plan clinique, on évaluait à 1 mois, 6 mois, 1, 2, 3, 4 et 5 ans les événements cardiaques majeurs (décès cardiaque, infarctus sur le vaisseau cible, TLR guidé par l’ischémie et thrombose intra-scaffold). Cent vingt six patients ont été initialement inclus, 66 % des lésions étaient simples, de type A/B1 (ACC/AHA). Aucun infarctus n’a été inclus dans cette étude. Quatre procédures se sont soldées par un échec de pose, le suivi présenté est celui des 122 patients avec un succès de procédure. Le suivi angiographique a pu être réalisé chez 113 patients, 40 patients ont été suivis par IVUS et 38 par OCT. Tous les patients ont pu être suivis cliniquement. Les résultats cliniques à 6 mois, 1, 2 et 3 ans sont résumés dans le tableau 1. Le taux de MACE à 3 ans est de 8,2 % avec un seul infarctus relié à une thrombose du vaisseau cible et aucune thrombose de stent documentée. Le critère d’évaluation principal de l’étude à savoir la perte tardive à 6 mois était à 0,20 ± 0,32 mm (intra-scaffold).
L’imagerie intravasculaire (tableau 2) nous apporte des renseignements très intéressants en IVUS avec la constatation d’un remodelage positif attesté par une augmentation à 6 mois de la taille du vaisseau s’accompagnant d’une augmentation de la lumière intra-artérielle moyenne et du diamètre du scaffold. Ces résultats sont maintenus à 18 et 36 mois. En OCT on ne retrouve pas cette donnée d’élargissement de la lumière artérielle, mais on confirme l’augmentation du diamètre du scaffold. Le pourcentage de couverture néo-intimale à 6 mois est excellent avec une couverture des mailles quasi complète (98,79 ± 1,79 %). Enfin, le scaffold est complètement résorbé après le 18e mois en OCT.
Technique de pose
Son utilisation requiert une sélection soigneuse des lésions, une prédilatation optimale, une technique de pose par étape et une postdilatation.
Une fois le stent sorti, il doit théoriquement être posé en 4 min. Il faut tout d’abord le laisser à température du corps pendant 60 secondes. Une fois au site de dilatation on peut déployer progressivement le scaffold pour les 2 premières atmosphères en respectant un intervalle de 10 secondes entre chaque atmosphère, puis de 2 secondes entre chaque sans dépasser la RBP et en maintenant la pression finale pendant 20 à 30 secondes. Une postdilatation est souhaitable sans dépasser le diamètre nominal de plus de 0,5 mm et sans déborder aux extrémités. Le stent est matérialisé par 2 marqueurs aux extrémités qui sont très peu radio-opaques et un système de réhaussement d’image type « stent-boost » est particulièrement utile pour guider la postdilatation.
L’utilisation des techniques d’imagerie intracoronaire est également souhaitable car elle permet d’optimiser la procédure. En effet le scaffold n’étant pas sur-dilatable comme une plateforme de stent métallique « classique », il est fondamental de choisir la bonne taille d’emblée et à cet égard l’OCT permet un sizing rigoureux et par la suite de guider la postdilatation et d’avoir une estimation finale du résultat la plus précise possible.
Conclusion
DESolve® au novolimus est un nouveau scaffold en PLLA avec des propriétés biomécaniques originales. Les premiers résultats cliniques sont encourageants et demandent confirmation sur de plus larges cohortes. Son utilisation doit pour le moment être limitée à des cas bien sélectionnés.
Cas clinique 1
Deux cas de pose de DESolve® sont illustrés, avec la lésion avant et après pose du scaffold et contrôle OCT final.
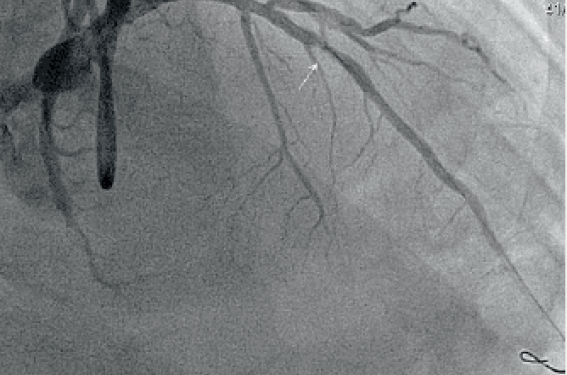
Dans le 1er cas (photo 1) il s’agit d’une lésion de la bissectrice pré-dilatée avec un ballon de 3,0/15, implantation d’un scaffold de 3,5/18 (photo 2) avec postdilatation par un ballon non compliant de 3,5/12 (photo 3).
Photo 1.
Photo 2.
Photo 3. Contrôle OCT après postdilatation avec un ballon non compliant de 3,5/12.
Cas clinique 2
Dans le 2e cas, il s’agit d’une lésion de l’interventriculaire antérieure moyenne (photo 4) prédilatée avec un ballon de 3,0/12, implantation d’un scaffold de 3,0/14 (photo 5) et post-dilatation par un ballon non compliant de 3,5/8 (photos 6 et 7).
Photo 4.
Photo 5.
Photo 6.
Photo 7. Contrôle OCT après postdilatation avec un ballon non compliant de 3,5/8.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


