Technologies
Publié le 28 fév 2014Lecture 8 min
La thromboaspiration : après 10 ans où en est-on ?
P. BARNAY, M. PANSIERI, J.-L. HIRSCH, M. METGE, CH d’Avignon
À la phase aiguë de l’infarctus du myocarde (IDM), la gestion du thrombus intracoronaire représente l’élément principal dans la qualité de la désobstruction.
Les stratégies de reperfusion doivent non seulement permettre la recanalisation du vaisseau coupable mais aussi et surtout une reperfusion tissulaire dont la qualité influence directement le pronostic de l’infarctus aigu.
Ces stratégies associant traitements antiplaquettaires, antithrombotiques et angioplastie primaire ont permis d’atteindre d’excellents taux de survie avec une faible morbidité à 30 jours.
On sait que la charge thrombotique initiale est prédictive d’événements cliniques à court et long terme(1), soit par la migration du thrombus responsable de no reflow mais aussi d’obstruction macrovasculaire(2), soit par une malapposition tardive des stents, après résorption du thrombus plaqué contre la paroi responsable d’un surcroît de thrombose de stent à 2 ans(3).
Quelle que soit la méthode d’appréciation de la qualité de la reperfusion, résolution du segment ST ou grade blush, il existe une nette corrélation entre le no reflow et la taille de l’infarctus, l’altération de la fonction contractile mais aussi la mortalité y compris lorsqu’un flux épicardique est restauré (TIMI 3)(4).
De tous les dispositifs mis à disposition pour lutter contre ce phénomène de migration thrombotique, seuls les systèmes de thromboaspiration manuelle ont permis d’obtenir des résultats cliniques étayés par des données scientifiques.
Le point sur les études des systèmes de thromboaspiration dans le SCA ST +
TAPAS (Thrombus Aspiration During Percutaneous Coronary Angioplasty for Acute Myocardial Infarction)(5) publiée en 2008 dans le New England Journal of Medicine, est une étude monocentrique qui a porté sur 1 071 patients randomisés avant la réalisation de l’angiographie entre angioplastie conventionnelle et angioplastie précédée d’une thromboaspiration.
Les auteurs ont retrouvé un bénéfice de la thromboaspiration à 30 jours basé sur le grade blush qui est le critère principal. À un an, ce bénéfice s’est traduit par une réduction de la mortalité alors que le design initial de l’étude ne l’avait pas prévu (figure 1).
Figure 1. Courbes Kaplan-Meier de mortalité dans l’étude TAPAS à 1 an en fonction de l’utilisation d’un système de thromboaspiration.
Dans cette étude le taux d’utilisation des anti-GpIIb/IIIa était de 96 %.
Ces résultats ont été confirmés par la métaanalyse ATTEMPT publiée en 2009 dans l’European Heart Journal(6) qui a poolé les données individuelles de 2 686 patients inclus dans 11 essais cliniques avec, là aussi, un bénéfice sur la mortalité. Ce travail suggère également une association synergique avec les anti-GpIIb/ IIIa (figure 2) et enfin, il enterre les systèmes de thromboaspiration mécanique.
Figure 2. Mortalité en fonction de la stratégie de reperfusion utilisée(6).
Plus récemment l’étude TASTE(7), publiée en 2013 dans le New England Journal of Medicine, vient tempérer l’enthousiasme soulevé par les travaux précédents. Il s’agit ici d’une étude multicentrique portant sur 7 244 patients randomisés entre angioplastie primaire classique et angioplastie primaire précédée d’une thromboaspiration. La randomisation a eu lieu après l’angiographie.
À 30 jours, il n’existe aucune différence sur la mortalité toutes causes qui est le critère principal de l’étude.
Importance de l’effectif, deux fois supérieur aux effectifs de tous les travaux randomisés sur ce sujet, caractère multicentrique et critère principal de mortalité sont les points forts de cette étude.
Néanmoins, plusieurs observations méthodologiques doivent être soulevées.
Il s’agit d’une étude dont les résultats sont basés sur un registre national, il n’y a donc pas de comité d’adjudication, seule la mortalité toutes causes peut être évaluée. Ni la charge thrombotique, ni le flux TIMI ou le grade blush postprocédure, ni la résolution du segment ST ou la taille de l’infarctus ne peuvent être analysés.
La randomisation a eu lieu après l’angiographie, un nombre important de patients ont été exclus de l’étude, notamment les patients à plus haut risque, dont le suivi est basé sur un registre, la décision de thromboaspiration étant alors laissée à la discrétion de l’opérateur sans que les motivations ne soient connues (figure 3)(7).
Figure 3. Courbes de Kaplan-Meier de mortalité toutes causes en fonction de l’utilisation d’un système de thromboaspiration(7).
Enfin, il existe une tendance à une augmentation des réhospitalisations pour IDM et des thromboses de stent dans le groupe angioplastie classique (figure 4)(7). Contrairement à TAPAS, le traitement antiagrégant plaquettaire ne retient que dans moins de 20 % des cas l’utilisation d’un anti-GpIIb/IIIa avec une différence significative entre les deux groupes en faveur de l’angioplastie classique.
On notera aussi la très forte utilisation de bivalirudine, dans près de 80 % des cas, ce qui n’est pas dans les pratiques françaises.
Figure 4. Courbes de Kaplan-Meier de réhospitalisation pour récidive d’infarctus du myocarde en fonction de l’utilisation d’un système de thromboaspiration(7).
Quel avenir pour la thromboaspiration ?
Les résultats récents de TASTE sont-ils de nature à modifier profondément le recours à la thromboaspiration ?
En raison des réserves citées plus haut mais également tant que les résultats à 1 an ne sont pas publiés, il semble prématuré d’abandonner la thromboaspiration.
En effet, en l’état actuel des données cliniques, cette technique doit garder sa place chez les patients à charge thrombotique importante mais en association aux anti-GpIIb/IIIa. L’effet synergique est clairement démontré, en particulier lorsqu’ils sont délivrés in situ comme le suggère les résultats d’INFUSE-AMI avec une efficacité sur la réduction de la taille de l’infarctus (figure 5)(8).
Figure 5. Taille de l’infarctus en fonction de la stratégie utilisée(8).
Par ailleurs, au-delà de son efficacité en phase aiguë, la réduction de la charge thrombotique doit permettre l’optimisation du stenting avec un effet espéré à long terme sur les thromboses de stent. On rappelle que dans TASTE, il existe une tendance à la réduction des thrombose de stent dans le groupe angioplastie associée à la thromboaspiration.
Enfin, plusieurs travaux préliminaires associant thromboaspiration soigneuse, anti-GpIIb/IIIa et angioplastie différée guidée par l’OCT suggèrent un recours moindre au stenting avec ce type de stratégie.
Caractéristiques du nouveau cathéter EXPORT
Dix ans après son premier modèle, Medtronic lance la 4e génération de son cathéter de thromboaspiration : l’Export Advance. Medtronic a fait évoluer son produit dans un souci d’amélioration des performances tout en maintenant sa facilité d’utilisation.
Plusieurs points ont été optimisés
Présence d’un mandrin ou stylet Délivérabilité supérieure et résistance à la plicature améliorée quelles que soient les anatomies grâce au mandrin préchargé et à la « full wall technology ».
Taux d’aspiration amélioré
Large lumière avec un diamètre interne augmenté (taux d’aspiration augmenté de 28 % vs Export AP).
Tip raccourci pour une meilleure capture de particules.
Compatibilité « buddy wire »
Capacité à utiliser un second guide pour faciliter le franchissement ou permettre le traitement des bifurcations.
Modalités pratiques d’utilisation du cathéter Export Advance
Le système de thromboaspiration progresse dans le cathéter guide avec son stylet en place. À proximité de la lésion, en fonction des tortuosités vasculaires, l’aspiration pourra s’effectuer en retirant le stylet. Le positionnement du cathéter se fait sous contrôle radiologique.
La lésion n’est jamais franchie brutalement, le thrombus est abordé par son pôle proximal, par des mouvements de va et vient dont la progression est arrêtée dès que le remplissage de la seringue s’interrompt. Tout franchissement de la lésion thrombotique avant une aspiration efficace expose au risque de migration thrombotique.
L’efficacité maximale est obtenue en répétant l’opération plusieurs fois.
Le retrait du cathéter s’effectue en aspiration pour éviter de déposer du matériel thrombotique en amont de la lésion, dans des vaisseaux collatéraux ou dans la sonde porteuse.
Le contrôle radiologique permettra d’apprécier l’efficacité de la procédure et d’indiquer le cas échéant de nouveaux passages du système de thromboaspiration.
Si le remplissage de la seringue ne reprend pas après retrait de la lésion, un thrombus occlusif est enclavé au sein du cathéter. Il convient alors de retirer l’ensemble du système et de le purger au sérum hépariné.
Enfin, le cathéter peut permettre l’infusion in situ d’anti-GpIIb/IIIa. Dans ce cas, il conviendra de s’assurer de l’absence de thrombus résiduel au sein du cathéter en le rinçant abondamment après l’avoir retiré avant d’injecter les antiagrégants plaquettaires en intracoronaire.
L’angioplastie sera précédée de l’injection de vasodilatateurs intracoronaires.
Conclusion
En dépit de résultats cliniques récents décevants sur la mortalité à 30 jours, les outils de thromboaspiration restent précieux dans la gestion du SCA ST+.
Ils apportent un bénéfice net en termes de qualité de la reperfusion tissulaire en particulier lorsqu’ils sont utilisés en association avec les anti-GpIIb/IIIa.
Ils permettent l’optimisation du stenting en cas de charge thrombotique importante.
Leur simplicité d’utilisation et l’innocuité de la technique doivent leur permettre de garder une place de choix dans l’arsenal mis à disposition du praticien dans la gestion du thrombus à la phase aiguë, dont la qualité influence le pronostic à court moyen et long terme.
Cas clinique
• Mr B. 38 ans est admis à la 2e heure d’un IDM en territoire antérieur. Il s’agit d’un patient fumeur. Il bénéficie d’un prétraitement par prasugrel, aspirine et énoxaparine.
La coronarographie révèle une occlusion de l’IVA proximale avec un flux TIMI 0 en aval (photo 1).
Photo 1. Occlusion aiguë de l’IVA proximale.
La thrombectomie répétée à 5 reprises permet de récupérer un important matériel thrombotique. Un bolus d’abxicimab est injecté en intracoronaire par le cathéter de thromboaspiration (photo 2).
Photo 2. Après thromboaspiration et infusion intracoronaire d’abxicimab.
La procédure permet de restaurer un flux TIMI 3 sans sténose résiduelle significative avec une normalisation du segment ST en fin de procédure.
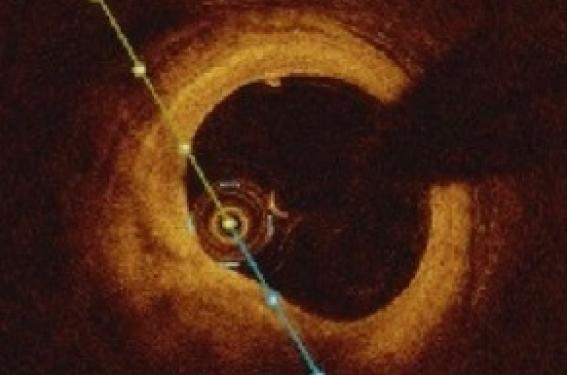
Le contrôle angiographique réalisé au 7e jour confirme le bon résultat initial (photo 3). L’OCT révèle une plaque TCFA sans sténose résiduelle, sans rupture de chappe (photo 4). On suppose un mécanisme d’érosion de plaque ne nécessitant pas de stenting complémentaire.
Photo 3. Contrôle angiographique au 7e jour.
Photo 4. Imagerie OCT de la lésion coupable au 7e jour. Plaque lipidique à chappe fine.
Ici la thromboaspiration a permis la restauration d’un flux TIMI 3 sans nécessité d’implanter un stent chez un patient jeune.
À 3 mois, la fraction d’éjection échographique est mesurée à 50 % avec une hypokinésie modérée antérolatérale.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


