Mise au point
Publié le 30 mar 2025Lecture 11 min
Scanner coronaire : vers une approche intégrée de l’anatomie et de la physiologie
Alain TAVILDARI, Hôpital du Valais, Centre hospitalier du Valais Romand, Sion, Suisse
Le scanner coronaire s’est imposé comme un outil diagnostique incontournable dans l’exploration des maladies coronariennes(1,2). Initialement centré sur l’évaluation anatomique des sténoses épicardiques, il bénéficie aujourd’hui des avancées technologiques et de l’intelligence artificielle (IA) pour intégrer une analyse physiologique de la circulation coronaire. Cette approche multimodale permet une stratification plus fine du risque et une personnalisation de la prise en charge, s’inscrivant pleinement dans l’évolution contemporaine de la cardiologie interventionnelle.
L a coronaropathie ne se résume pas à la simple présence d’une sténose épicardique obstructive.
UNE VISION GLOBALE DE LA CORONAROPATHIE
Trois phénotypes cliniques majeurs doivent être pris en compte :
Sténose épicardique obstructive
Elle est définie par un rétrécissement luminal significatif (≥ 50 % pour le tronc commun gauche, ≥ 70 % pour les autres segments), elle est responsable d’ischémie myocardique. Son diagnostic repose sur l’imagerie anatomique et fonctionnelle, avec une stratégie thérapeutique combinant traitements médicamenteux et revascularisation par angioplastie ou chirurgie.
Plaque vulnérable
Elle est souvent asymptomatique et est le siège de remaniements pariétaux susceptibles de déclencher un syndrome coronarien aigu (SCA ). Sa détection repose sur des marqueurs scanographiques prédictifs d’événements graves(3), tels que le remodelage positif, la faible densité (< 30 UH), la microcalcification ou l’infiltration péricoronaire.
Dysfonction microvasculaire
Elle est présente dans plus de 50 % des coronaropathies sans sténose significative et est responsable d’ischémie myocardique par augmentation des résistances microcirculatoires. Le scanner permet d’en évaluer l’impact via l’analyse de la perfusion myocardique dynamique. Dans cet article nous avons choisi de développer l’ischémie et la plaque vulnérable, l’étude de la dysfonction microvasculaire par la perfusion moycardique pourra faire l’objet d’un article à part entière.
ISCHÉMIE MYOCARDIQUE : CONSÉQUENCE FONCTIONNELLE DES STÉNOSES
L’ischémie myocardique résulte d’un déséquilibre entre l’apport et la demande en oxygène du myocarde. Elle survient en présence d’une sténose coronarienne significative réduisant le flux sanguin au repos ou à l’effort. Son identification repose sur des tests fonctionnels tels que l’échographie d’effort, la scintigraphie myocardique, l’IRM de stress, ou encore, la FFR invasive.
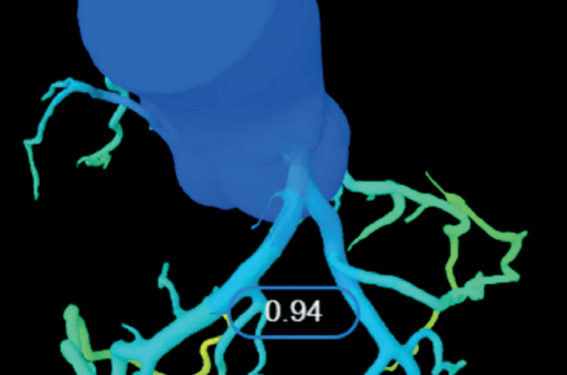
L’apport du scanner coronaire est majeur dans l’évaluation de l’ischémie grâce à la FFR virtuelle (FFRCT), qui permet une analyse fine et non invasive des répercussions hémodynamiques des sténoses (figure 1)(4). La FFRCT repose sur des modèles de dynamique des fluides (computational fluid dynamics, CFD)(5) qui intègrent les équations de Navier-Stokes pour modéliser les gradients de pression et les variations de flux coronaires.
Figure 1. A : Scanner et FFRCT montrant une atteinte athéromateuse diffuse de l’IVA avec une lésion sténosante sur le segment distal. La FFRCT de la lésion est à 0,75. B : Angiographie de l’IVA ne montrant pas de lésion serrée mais la FFR invasive retrouve la même mesure de 0,75 en hyperémie.
Cette approche a été validée par plusieurs études cliniques de grande envergure :
• PLATFORM(6) : démontrant une réduction significative des coronarographies inutiles grâce à la FFRCT.
• ADVANCE(7) : confirmant la fiabilité diagnostique de la FFRCT avec une excellente corrélation aux mesures invasives.
• DISCOVER-FLOW(8) : démontrant la capacité de la FFRCT à identifier les sténoses fonctionnellement significatives avec une sensibilité de 86 % et une spécificité de 79 %.
D’un point de vue technique, il existe une deuxième méthode d’évaluation de la FFR virtuelle par scanner basée sur l’intelligence artificielle (IA). Cette intégration de l’IA dans le traitement des images permet aujourd’hui d’automatiser la segmentation des vaisseaux et d’améliorer la précision des calculs hémodynamiques en quelques minutes seulement, réduisant ainsi le délai diagnostique.
VULNÉRABILITÉ DES PLAQUES : UNE NOTION INDÉPENDANTE DE L’ISCHÉMIE
Contrairement à l’ischémie myocardique, conséquence directe d’une sténose coronarienne significative, la vulnérabilité d’une plaque athéromateuse repose sur un ensemble de caractéristiques morphologique s, histologiques et biologiques qui prédisposent à sa rupture, initiant ainsi la cascade thrombotique à l’origine des syndromes coronariens aigus. Dans une récente mise au point publiée dans JACC : Cardiovascular Imaging(9), Peter Libby et ses collaborateurs revisitent ce concept de « plaque vulnérable », introduit il y a plus de trois décennies à partir d’observations anatomopathologiques et d’études épidémiologiques ayant identifié la rupture de plaque suivie de thrombose comme mécanisme central des SCA.
Aujourd’hui, la notion de plaque à haut risque s’est élargie. Elle englobe les trois grands phénotypes lésionnels susceptibles de déclencher une thrombose coronaire :
– La rupture de plaque, favorisée par un cœur lipidique nécrotique instable ;
– L’érosion de plaque, souvent associée à une fine chape fibreuse (< 65 μm) et une inflammation endothéliale ;
– Les nodules calcifiés éruptifs, résultant de microcalcifications activement remodelées.
La caractérisation précise de ces plaques impose une approche intégrée, combinant l’analyse de la morphologie et de l’activité des lésions. L’imagerie endocoronaire (IVUS, OCT) a longtemps constitué l’outil de référence pour leur identification. Toutefois, les récents progrès du scanner coronaire, tant en résolution spatiale qu’en analyse fonctionnelle et inflammatoire, permettent aujourd’hui une évaluation non invasive fine des plaques athéromateuses, offrant ainsi de nouvelles perspectives pour la stratification du risque et la prise en charge personnalisée des patients.
ANALYSE DE LA COMPOSITION DE LA PLAQUE ET CHARGE ATHÉROMATEUSE GLOBALE
L’étude détaillée de la plaque athéromateuse est essentielle pour évaluer son risque de complication aiguë. Le scanner coronaire permet d’analyser sa composition et d’établir une charge athéromateuse globale, paramètre clé pour la stratification du risque cardiovasculaire(10).
Charge athéromateuse globale : un indicateur prédictif
La charge athéromateuse globale correspond à la quantité totale de plaque présente sur l’ensemble du réseau coronaire. Contrairement à l’évaluation segmentaire d’une lésion isolée, cette approche systémique permet d’anticiper le risque cardiovasculaire global(11). Plusieurs scores quantitatifs ont été développés pour estimer cette charge :
– Segment involved score (SIS) : nombre total de segment s atteints par des plaques.
– CT-Leaman score : intégration de la localisation des plaques et de leur importance dans la perfusion myocardique.
– Plaque burden score (PBS) : proportion de la lumière vasculaire occupée par la plaque.
Ces indices sont aujourd’hui optimisés par l’intelligence artificielle, qui permet d’automatiser leur calcul à partir des images scanographiques, réduisant ainsi l’hétérogénéité des interprétations.
Composition de la plaque : caractéristiques et vulnérabilité
Au-delà de cette valeur quantitative, le scanner coronaire permet de caractériser finement la plaque athéromateuse en fonction de ses composants structurels (figure 2)(12). Ceux-ci sont classés en trois grandes catégories, selon leur densité en unités Hounsfield (UH).
Figure 2. Analyses de plaques.
• Plaques calcifiées (densité > 350 UH) :
– constituées principalement de dépôts de calcium ;
– associées à un remodelage vasculaire chronique ;
– peu susceptibles de rupture aiguë mais peuvent contribuer à une sténose obstructive ;
– peuvent compliquer les procédures de revascularisation percutanée en raison de leur rigidité.
• Plaques fibreuses (densité entre 130 et 350 UH) :
– composées de tissu conjonctif dense ;
– tendance à la stabilisation mais peuvent évoluer vers des plaques plus vulnérables ;
– modérément associées à un risque de rupture, notamment si un cœur lipidique est présent.
• Plaques lipidiques ou hypodenses (densité < 30 UH) :
– présence d’un cœur lipidique riche en cholestérol ;
– chape fibreuse fine, favorisant la rupture et la formation de thrombus ;
– fortement associées aux syndromes coronariens aigus (SCA), même en l’absence de sténose significative.
La plaque vulnérable typique présente souvent un remodelage positif, des microcalcifications, une densité faible et/ ou un signe en napkin ring, prédictifs d’événements cardiovasculaires majeurs. Si deux de ces éléments sont présents, alors la plaque est qualifiée de haut risque (high risk plaque, HRP) (figure 3).
Figure 3. A : Plaque non sténosante de l’IVA proximale, mixte calcifiée et hypodense, évocatrice d’une plaque vulnérable. B : Analyse de la composition de la plaque et étude de l’inflammation par index d’atténuation du tissu adipeux péricoronaire (FAI). C : FFRCT confirmant le caractère non ischémiant de la lésion. D : Angiographie : discrète plaque modérément calcifiée de l’IVA proximale. E : imagerie OCT de la plaque mettant en évidence une érosion de l’endothélium en regard d’une calcification pariétale.
Importance des plaques lipidiques dans la vulnérabilité coronarienne
Parmi ces différentes catégories, les plaques lipidiques sont Figure 2. Analyses de plaques. les plus préoccupantes en raison de leur instabilité. Leur déstabilisation est souvent liée à des processus inflammatoires, qui fragilisent la chape fibreuse et favorisent la rupture. Plusieurs éléments renforcent la prédictibilité de ces plaques pour les événements aigus :
• Le fat attenuation index (FAI) : un marqueur de l’inflammation péricoronaire, validé par l’étude CRISP-CT(13), qui permet d’identifier les plaques les plus à risque.
• Le wall shear stress (WSS)(14) : force de cisaillement exercée par le flux sanguin, qui influence la progression et la rupture des plaques (en cours d’évaluation pour le moment et non encore intégrée en pratique de routine).
Ainsi, une plaque lipidique peut provoquer un infarctus du myocarde sans sténose obstructive, ce qui explique pourquoi la seule analyse anatomique des coronaires ne suffit plus à prédire les événements cardiovasculaires.
SCANNER CORONAIRE : un outil unifiant les deux concepts ischémie et vulnérabilité
Ces deux approches, longtemps séparées, convergent vers une stratification complète du risque cardiovasculaire, intégrant à la fois l’obstruction et la susceptibilité de la plaque à l’événement aigu. L’intelligence artificielle appliquée à l’imagerie permet aujourd’hui d’automatiser ces analyses et d’optimiser la détection des patients à haut risque.
INTÉGRATION DES SCORES DIAGNOSTIQUES : CAD-RADS 2.0(15) et perspectives
L’évaluation et la classification des anomalies coronariennes détectées par le scanner sont depuis plusieurs années standardisées par le score CAD-RADS 2.0 (Coronary Artery Disease-Reporting and Data System), qui intègre à la fois les notions de charge athéromateuse et d’ischémie.
CAD-RADS 2.0 : une prise en compte élargie du risque
CAD-RADS 2.0 améliore la classification des lésions coronariennes en intégrant :
• La charge athéromateuse globale (P pour plaque burden) : permet d’évaluer l’étendue de l’atteinte athéromateuse globale, en complément de l’analyse purement anatomique des sténoses.
• L’ischémie (I pour ischemia) : introduit une gradation du retentissement fonctionnel basé sur la FFRCT, facilitant ainsi la prise en charge thérapeutique.
Cette mise à jour du score reflète l’évolution des connaissances en cardiologie interventionnelle et l’intégration des paramètres physiopathologiques dérivés du scanner coronaire.
Vers un CAD-RADS 3.0 ?
Malgré ces avancées, CAD-RADS 2.0 ne prend pas encore en compte certains biomarqueurs majeurs de vulnérabilité des plaques, notamment la FAI, et peut-être demain le WSS.
L’émergence de nouvelles technologies d’IA et de modèles de prédiction pourrait conduire à une version CAD-RADS 3.0, intégrant ces biomarqueurs pour affiner encore davantage la stratification du risque cardiovasculaire. Une telle évolution permettrait de mieux identifier les patients à haut risque avant la survenue d’événements aigus et d’optimiser les stratégies thérapeutiques.
PATIENTS À RISQUE DE RUPTURE DE PLAQUE : la question irrésolue du dépistage
L’un des défis majeurs de la prévention cardiovasculaire est l’identification des patients à risque de plaque vulnérable, avant la survenue d’un événement aigu. Actuellement, la stratification du risque chez le patient asymptomatique repose sur les facteurs de risque traditionnels (âge, tabagisme, diabète, hypercholestérolémie, hypertension, hérédité). Toutefois, ces critères ne permettent pas toujours d’identifier les patients réellement à haut risque de rupture de plaque.
L’enjeu est donc de définir une population cible pour un dépistage efficace. Plusieurs approches sont envisageables :
• Dépistage systématique des sujets asymptomatiques à haut risque : population ayant une hérédité forte, une dyslipidémie importante, une inflammation de bas grade chronique, un âge supérieur à une limite qui reste à définir, etc.
• Approche individualisée basée sur les biomarqueurs biologiques : Lp(a), CRPus, etc.
• Intégration de l’IA pour améliorer la prédiction : les algorithmes de machine learning pourraient identifier des profils à risque sur la base de milliers de paramètres anamnestiques, biologiques et cliniques.
Il reste cependant à définir quels patients bénéficieraient réellement d’un dépistage précoce et quelle stratégie thérapeutique appliquer en cas de découverte d’une plaque vulnérable en l’absence de sténose significative. L’établissement d’un CAD-RADS 3.0 intégrant les biomarqueurs inflammatoires et mécaniques pourrait être une première étape vers une meilleure identification des candidats à un traitement préventif personnalisé.
L’ANGIOPLASTIE DES PLAQUES VULNÉRABLES NON ISCHÉMIANTES : une approche séduisante mais encore non validée
L’identification des plaques vulnérables grâce au scanner coronaire a soulevé la question de leur éventuel traitement préventif par angioplastie, même en l’absence d’ischémie. L’idée sous-jacente serait de stabiliser mécaniquement ces plaques avant qu’elles ne se rompent et ne déclenchent un syndrome coronarien aigu. En théorie, le stenting préventif pourrait limiter le risque d’évolution défavorable des plaques riches en lipides avec une chape fibreuse fine et une inflammation péricoronaire active. Nous irions alors vers des angioplasties techniquement beaucoup plus simples, mais avec un impact nettement plus important en termes de pronostic.
Cependant, cette approche reste controversée en raison du manque de données probantes issues d’essais cliniques randomisés. Contrairement aux sténoses ischémiantes, dont la revascularisation a démontré un bénéfice clinique dans de nombreuses études, l’angioplastie des plaques non obstructives et non ischémiantes n’a pas encore fait l’objet de validations rigoureuses.
L’étude PREVENT(16) a démontré un intérêt à cette stratégie préventive mais sur un objectif primaire composite et son interprétation doit donc être prudente. En attendant, la prise en charge des plaques vulnérables repose principalement sur une optimisation du traitement médical avec des hypolipémiants intensifs, des anti-inflammatoires ciblés et une surveillance clinique rapprochée.
Plusieurs questions restent ouvertes
• Quels patients sélectionner ? La simple présence d’une plaque vulnérable est-elle un critère suffisant ou faut-il intégrer des biomarqueurs inflammatoires et mécaniques comme le FAI et le WSS ?
• Quels bénéfices attendre ? L’angioplastie de plaques non obstructives apporte-t-elle une réduction significative des événements cardiovasculaires ?
• Quels risques ? L’implantation d'un stent sur une plaque non ischémiante pourrait induire des complications thrombotiques ou des dissections coronaires à court terme, et une re sténose à moyen ou long terme, sans parler du risque de la double antiagrégation plaquettaire.
CONCLUSION
• Le scanner coronaire dépasse aujourd’hui la simple analyse anatomique pour intégrer des paramètres physiopathologiques avancés. L’utilisation combinée des techniques de FFR virtuelle, d’analyse de la composition des plaques et de FAI, appuyées par l’intelligence artificielle et les modèles mathématiques de dynamique des fluides, permet d’évaluer simultanément l’ischémie myocardique et la vulnérabilité des plaques.
• Ces avancées positionnent le scanner comme un outil clé en cardiologie interventionnelle, contribuant à une meilleure stratification du risque et à une personnalisation accrue des stratégies thérapeutiques. L’objectif ultime étant de détecter précocement les patients à risque et d’optimiser leur prise en charge avant la survenue d’événements aigus.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


