Vasculaire
Publié le 30 nov 2010Lecture 9 min
Traitement endovasculaire des anévrismes de l’aorte abdominale - Une technique accessible et reconnue en France
J. BUSQUET, J. KUSMIEREK, P. SINTES, Clinique chirurgicale Val d’Or, Saint-Cloud
Longtemps « chasse gardée » de la chirurgie vasculaire conventionnelle, le principe classique du traitement de l’anévrisme de l’aorte abdominale (AAA) par laparotomie et mise à plat greffe/dacron, a véritablement volé en éclats quand la faisabilité et les avantages d’une simple exclusion anévrismale endovasculaire par endoprothèse couverte introduite par mini-incisions au niveau de l’aine, ont été prouvés. Fortement mis en cause à son introduction par les piliers du conservatisme, ce type de procédure s’est progressivement affirmé à l’échelon mondial, notamment lors de la publication des grandes séries randomisées (figure 1).
Figure 1. Mortalité immédiate comparative entre endoprothèse et chirurgie.
La technique s’est également améliorée en termes de diamètre de matériel de pose et de résistance des composants des endoprothèses, pour devenir une alternative aujourd’hui incontournable à la chirurgie ouverte.
L’évolution de la technologie en perpétuelle progression apportera à court terme les solutions potentielles d’utilisation et d’indications plus étendues.
C’est en 1991 qu’un chirurgien cardiovasculaire argentin, le Dr Juan Parodi met au point avec succès à Buenos Aires, le principe et l’application inaugurale chez l’homme d’une prothèse aortique en polyester introduite par voie endovasculaire et fixée par un stent métallique de grande taille, afin d’exclure un AAA.
Ces premiers pas sont relayés dès 1994 par l’apparition du concept de bifurcation aortoiliaque modulaire, permettant un meilleur ancrage distal de l’endoprothèse tout en assurant une meilleure exclusion de l’anévrisme.
Un nouveau monde était né ! Les principaux pionniers de cette technique, les Prs James May et Geoffrey White (Royal Prince Alfred Hospital, Sydney, Australie), le Dr Edward Diethrich (Phoenix, États-Unis) et les Prs Thomas Fogarty et Christopher Zarins (Standford University Hospital, San Francisco, États- Unis), rapportent alors leurs larges séries de patients, participent à la mise au point de nouveaux modèles et inventent la terminologie médicale inhérente à la technique, notamment la définition des endofuites postopératoires.
Rapport anatomique dʼun anévrisme de lʼaorte abdominale.
Situation actuelle en France
Les premières poses d’endoprothèses aortiques pour exclusion d’AAA en France remontent à 1995, de façon limitée, grâce à un seul modèle alors disponible. L’année suivante, pour des raisons réglementaires de matériovigilance et d’analyse approfondie des résultats, la technique est réservée en exclusivité aux hôpitaux publics. Elle devient cependant disponible à tous les établissements de santé français publics ou privés à partir de juillet 2004, avec remboursement de la prothèse par la Sécurité sociale à condition de respecter certaines recommandations limitant son utilisation aux patients à haut risque.
Depuis les dernières recommandations Afssaps-HAS, datant de novembre 2009, les endoprothèses aortiques peuvent être aujourdʼhui proposées en première intention dans le traitement de lʼAAA, quel que soit le risque chirurgical considéré, quʼil soit normal ou élevé.
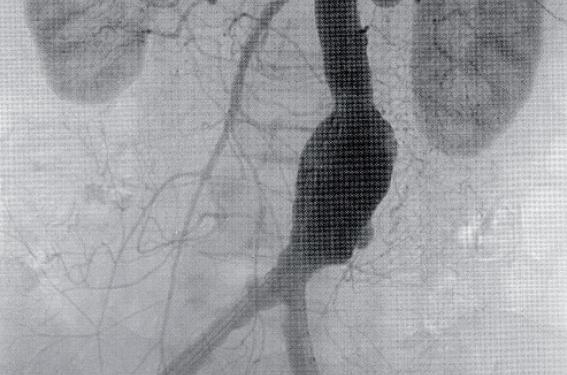
Quel que soit le mode de découverte de l’anévrisme, orientée ou fortuite, qu’il soit asymptomatique ou douloureux, par examen clinique simple, radiographie sans préparation de l’abdomen, échographie abdominale ou écho-Doppler aortique, l’angioscanner abdominal en coupes millimétrées avec reconstructions 3D est l’examen complémentaire essentiel en ce qui concerne la confirmation diagnostique, l’approche anatomique et la décision thérapeutique, notamment endovasculaire. Les indications actuellement reconnues sont les AAA de localisation sous-rénale (figure 2) dont le diamètre transversal externe est ≥ 5 cm dans sa plus grande dimension calculée sur des coupes scanner effectuées tous les 5 mm.
Une augmentation de diamètre ≥ 1 cm d’un anévrisme au cours d’une année, démontrée par deux mensurations successives comparatives, constitue également une indication au traitement.
Figure 2. Morphologie idéale dʼanévrisme de lʼaorte abdominale pour traitement endovasculaire.
Un AAA connu qui devient symptomatique avec installation durable dʼun syndrome douloureux abdominal antérieur ou dorsolombaire, doit être exploré et pris en charge dans un délai rapide.
Ce prodrome peut traduire un remaniement pariétal de l’anévrisme, signe de rupture imminente ou retardée, par phénomène d’aggravation pouvant aller du syndrome préfissuraire à la fissuration couverte et à la rupture contenue ou ouverte, cette dernière éventualité, nécessitant un geste chirurgical immédiat.
Expérience personnelle
Ayant eu l’avantage de participer aux premières poses d’endoprothèses aortiques en France pour AAA dès 1995, notre intérêt pour cette technique innovante s’est confirmé au fil des années d’expérience. Entre octobre 2004 et septembre 2010, parmi les 110 cas d’AAA diagnostiqués dans notre département, nous rapportons une série de 61 patients traités par endoprothèses aortiques, 57 hommes et 4 femmes, d’une moyenne d’âge de 71 ans, allant de 52 à 89 ans. La mortalité opératoire concerne deux patients, une rupture aortique massive postimplantation à J 2, ainsi qu’un décès brutal à J 3 par infarctus myocardique. La mortalité tardive concerne trois patients, une insuffisance respiratoire terminale au 2e mois, une néoplasie pulmonaire à 1 an ainsi qu’une insuffisance cardiaque globale durant la 2e année postopératoire. Six patients ont nécessité une intervention urgente pour, respectivement, quatre syndromes fissuraires, une fistule aortodigestive ainsi qu’une ischémie mésentérique associée. Il est noté une seule conversion chirurgicale pour migration proximale précoce de l’endoprothèse, sur un collet aortique conique et angulé.
Sur le plan technique, 91 % des patients ont bénéficié d’une endoprothèse aortobi-iliaque modulaire, tandis qu’une endoprothèse aortouni-iliaque et pontage croisé fémoro-fémoral avec occlusion iliaque controlatérale étaient nécessaires dans 5 cas, pour raison morphologique ou dans le cadre de l’urgence (figure 3). Trois patients porteurs d’anévrisme iliaque associé ont bénéficié d’une embolisation hypogastrique par coils, préalablement à l’implantation de l’endoprothèse aortique.
Figure 3. Endoprothèse aorto-uni-iliaque et pontage croisé.
Le suivi des patients a révélé six cas d’endofuites de type II (9,8 %) par réalimentation rétrograde via les artères lombaires, sans conséquence clinique, ainsi que deux cas de thrombose iliaque unilatérale tardives (3,2 %) traitées favorablement par pontage croisé fémoro-fémoral.
Modalités de surveillance
La pose d’une endoprothèse aortique pour exclusion d’AAA impose une obligation de surveillance postopératoire régulière faisant partie intégrante du processus thérapeutique et du consentement éclairé préalable.
Classiquement, lʼexamen de référence de contrôle est la tomodensitométrie avec injection de produit de contraste quʼil convient de réaliser en théorie dans les 30 jours postopératoires, mais préférablement entre 48 à 72 heures après la pose, complété par un ASP à la recherche dʼune fracture des structures métalliques internes à lʼendoprothèse (figure 4).
Figure 4. Contrôle postopératoire par angioscanner et reconstruction 3D.
Le scanner sera répété à 6, 12 et 24 mois, remplacé par l’écho-Doppler artériel en cas de contre-indication (allergie à l’iode, insuffisance rénale, perte du capital veineux) ou d’impossibilité de réalisation du scanner.
Le diamètre postopératoire de l’anévrisme, doit en théorie décroître progressivement avec le temps, signant l’exclusion totale du sac anévrismal par l’endoprothèse et l’involution de l’anévrisme. Toute augmentation de la taille de l’anévrisme doit faire rechercher une cause, soit une endofuite, soit un phénomène d’endotension, pouvant conduire à une conversion chirurgicale en cas d’augmentation substantielle de taille de l’anévrisme au cours du suivi comparatif. Les endofuites de type I doivent être traitées dans un premier temps par l’adjonction d’un manchon proximal ou par une endoprothèse couverte iliaque de complément. En cas de persistance de la fuite, une conversion est hautement recommandée afin d’éviter une rupture secondaire de l’anévrisme.
Les endofuites de types II apparaissent plus bénignes et doivent actuellement être seulement suivies. Elles sont en règle développées à partir d’une circulation rétrograde de l’artère mésentérique inférieure ou des artères lombaires, réalimentant le sac anévrismal de façon souvent partielle.
Conseils pratiques
La gestion endovasculaire de la pathologie anévrismale aortique ne peut être envisagée que dans des structures de soins dotées d’un service d’imagerie moderne et d’une réanimation chirurgicale pour surveillance systématique postopératoire immédiate de 24 heures minimum ou en cas de complications précoces. La réalisation de l’acte technique doit être au mieux effectuée dans un bloc opératoire de grande taille, équipé spécifiquement d’une radiologie peropératoire de résolution suffisante avec présence d’un injecteur de produits de contraste, par des opérateurs rompus aux techniques endovasculaires complexes.
La possibilité de disposer à tout moment d’un large éventail de matériel endovasculaire, guides, introducteurs, stents, afin d’accomplir un geste non programmé complémentaire, est une absolue nécessité.
Le recueil des mensurations préopératoires de l’anévrisme ou sizing constitue une étape fondamentale afin de sélectionner l’endoprothèse la mieux adaptée à la forme et aux dimensions du collet aortique sous-rénal, à la hauteur anévrismale et aux tailles des artères iliaque réceptrices.
Lʼinformation préalable donnée au patient et à sa famille constitue une obligation administrative qui devra être effectuée par lʼopérateur en personne, afin de recueillir la signature du consentement éclairé, exception faite dʼune indication dʼextrême urgence.
La collaboration multidisciplinaire, regroupant chirurgien, angiologue, cardiologue, radiologue, réanimateur, prend toute sa valeur dans le traitement endovasculaire de l’AAA, autant au niveau décisionnel qu’en matière de suivi postopératoire ou à distance.
Conclusion
Le traitement des AAA par endoprothèse couverte, initié il y a 20 ans, arrive dans sa phase de maturité. Parfaitement reconnue en France, la technique est aujourd’hui sûre et accessible à tout patient adressé à un établissement doté d’un plateau technique adapté avec une prise en charge pluridisciplinaire pré- et postopératoire.
Un facteur essentiel de réussite thérapeutique réside dans le choix des indications qui doivent être parfaitement mesurées en tenant compte de la morphologie de l’aorte et des axes iliaques.
La tendance technologique dans ce domaine évolue rapidement vers une implantation totalement percutanée d’endoprothèse de plus fin diamètre d’introduction, tout en visant à l’amélioration de sa fixation aortique proximale, grâce à l’adjonction de fins crochets d’accroche pariétale ou l’utilisation de colle biologique, dans le but de parfaire l’apposition puis la cicatrisation artérielle sur les zones d’ancrage.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


