Technologies
Publié le 15 oct 2019Lecture 8 min
La bonne équation : Efficacité + sécurité = ELUVIA™
Yann GOUËFFIC, service de chirurgie vasculaire, CHU de Nantes
L’artériopathie oblitérante des membres inférieurs (AOMI) affecte environ 27 millions d'adultes en Europe et en Amérique du Nord et est associée à une morbidité et une mortalité significatives(1). Les personnes atteintes d’AOMI, y compris celles qui ne signalent pas de symptômes, ont une altération de leur qualité de vie et de leur mobilité au fil du temps(2). Le tableau clinique de l’AOMI varie. Les symptômes les plus courants sont une gêne à la marche (claudication intermittente) et dans les cas les plus sévères une mise en jeu du pronostic du membre inférieur (ischémie critique) avec l’apparition de douleurs au repos, de troubles trophiques, voire de gangrène pouvant nécessiter une amputation du membre inférieur.
La gestion de l’AOMI dépend de la symptomatologie du patient(2). En cas de claudication, le traitement doit être axé sur les exercices supervisés et les médicaments destinés à réduire le risque d’événements cardiovasculaires et sur l'augmentation du périmètre de marche. L’absence d’amélioration à la suite de la rééducation par la marche et/ou par le traitement doit conduire à une revascularisation du membre inférieur selon le terrain, la localisation et l’étendue des lésions observées.
Le traitement endovasculaire des lésions fémoropoplitées a fait l’objet de nombreuses études et est désormais considéré comme une stratégie de première intention pour la plupart des lésions fémoropoplitées.
Dans les années 2000, les stents autoexpansibles ont démontré leur supériorité par rapport à l’angioplastie percutanée transluminale mais les taux de resténoses intrastent restent toujours élevés (19 à 37 %)(3-6). Depuis une dizaine d’années, les stents à élution de paclitaxel ou les ballonnets à élution de paclitaxel ont été évalués avec succès pour prévenir l’hyperplasie intimale(7-11). Cependant, la resténose s’explique aussi par le rappel élastique de la paroi artérielle dans les suites immédiates de l’angioplastie et par un remodelage constrictif et fibreux survenant dans les mois après l’intervention.
L’échafaudage de l’artère par une structure rigide telle un stent semble être un moyen efficace de prévenir le rappel élastique et le remodelage constrictif.
En 2011, Dake et al. ont évalué un stent à élution de paclitaxel sans polymère et ont montré que le stent Zilver® PTX® (Cook Medical) était supérieur en termes de perméabilité et de réintervention à l’angioplastie au ballonnet avec stenting provisoire(7). Mais il reste encore de la place pour l’amélioration, notamment en termes de plateforme et de contrôle de la libération du médicament. En effet, le Zilver® PTX® n’utilise pas de polymère pour contrôler la libération du paclitaxel, et environ 95 % du paclitxel est délivré à la paroi artérielle dans les 24 heures suivant son implantation. Après 56 jours, le paclitaxel n’est plus détectable dans la paroi artérielle(12).Cependant, la resténose intrastent survient principalement dans l’année suivant l’implantation du stent au niveau fémoropoplité(13). Par conséquent, afin de prévenir la resténose intrastent, la cinétique du relargage du produit actif doit être prolongée au cours de la première année post-implantation.
Le stent actif ELUVIA™ (Boston Scientific)
Ce stent est caractérisé par une plateforme de nitinol (INNOVA™, Boston Scientific) qui a déjà été bien évaluée(14). D’autre part, le produit actif utilisé est le paclitaxel à une concentration de 0,167 μg/mm2. Comme le montre le tableau 1, la quantité de paclitaxel est plus faible pour ELUVIA™ par rapport aux autres dispositifs à élution de paclitaxel. Le polymère est similaire au polymère utilisé pour les stents à élution de paclitaxel coronaire de type XIENCE V (Abbott Vascular) et PROMUS PREMIER™ (Boston Scientific). Par conséquent, l’innocuité et la biocompatibilité du polymère ont déjà été bien évaluées.
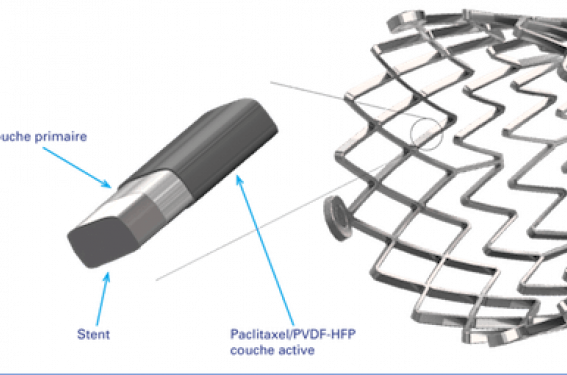
Le polymère est composé d’une double couche (figure 1). La couche interne (PBMA) favorise l’adhésion de la couche active à l’endoprothèse vasculaire et la couche active (paclitaxel, PVDF-HFP) contrôle la libération de paclitaxel. Après des études précliniques prometteuses(15), ELUVIA™ a été évalué pour la première fois chez l’homme dans le registre MAJESTIC ayant inclus 57 patients traités pour des lésions fémoropoplitées d’une longueur moyenne de 70,8 ± 28,1 mm(16). La perméabilité primaire à 1 an était de 96,4 % (estimation Kaplan Meier). Compte tenu de ces résultats encourageants, un essai contrôlé randomisé (2:1) comparant ELUVIA™ et Zilver® PTX® a été mis en place pour le traitement des lésions fémoropoplitées(17).
Figure 1 : Structure du polymère du stent ELUVIA™.
IMPERIAL est une étude clinique de non-infériorité incluant des patients présentant une claudication ou une ischémie critique (Rutherford 2 à 4) et des lésions allant de 30 à 140 mm de long. Soixante-cinq centres ont inclus 465 patients. Le critère d’évaluation principal d’efficacité était la perméabilité primaire à 12 mois, évaluée en échographie Doppler et définie par un index du pic de vélocité systolique égal ou inférieur à 2,4 lors de la visite de suivi à 12 mois et en l’absence de revascularisation ou de pontage concernant la lésion cible (TLR). Une analyse de supériorité post-hoc a été réalisée pour le critère d’évaluation principal d’efficacité.
Le critère d’évaluation principal de sécurité était la survenue d’événements indésirables majeurs, définis comme l’ensemble des décès toutes causes sur 1 mois, l’amputation majeure du membre cible sur 12 mois ou la revascularisation d’une lésion cible sur 12 mois. Un laboratoire d’échographie Doppler et un comité des événements cliniques indépendants avaient été recrutés pour évaluer les critères d’évaluation principaux. Entre décembre 2015 et février 2017, 309 patients avaient été inclus dans le groupe ELUVIA™ et 156 patients dans le groupe Zilver® PTX®. L’âge moyen était de 68,5 à 67,8 ans et 42 à 44 % des patients étaient diabétiques. La longueur moyenne des lésions traitées variait de 81,8 à 86,5 mm. Après 1 an, 276 et 133 patients étaient évalués dans les groupes ELUVIA™ et dans celui de Zilver® PTX®.
La non-infériorité d’ELUVIA™ était démontrée pour les paramètres d’efficacité et de tolérance à 12 mois. Une perméabilité primaire a été observée chez 231 (87 %) des 266 patients du groupe ELUVIA™ et chez 106 (82 %) des 130 patients du groupe Zilver® PTX® (p < 0,0001) (figure 2). De plus, la supériorité était atteinte dans l’analyse post-hoc de la perméabilité primaire à 12 mois.
Figure 2 : Perméabilité primaire (analyse de survie Kaplan Meier).
Parmi les critères d’évaluation secondaire, les taux de TLR étaient respectivement de 4,6 % et 8,1 % pour ELUVIA™ et Zilver® PTX® (p = 0,0142). Enfin, les taux de thrombose sous ELUVIA™ et Zilver® PTX® étaient respectivement de 1,7 % et 4,0 % (p = 0,20).
Fait intéressant, certains sous-groupes de l’étude MAJESTIC ont pu être analysés. Dans le groupe ELUVIA™, 31,2 % (n = 96) des lésions étaient des occlusions chroniques totales (CTO) dont la longueur moyenne était de 94,4 mm(18). À 1 an, le taux de perméabilité primaire était de 83,9 %. Cependant, dans ce même groupe, les lésions non occlusives avaient tendance à avoir une perméabilité primaire supérieure à 1 an (90,6 %). Par ailleurs, 193 lésions étaient considérées comme ayant des calcifications modérées ou graves et leur taux de perméabilité primaire à 1 an ne différait pas des lésions n’ayant pas de calcifications ou jugées légères (modérément/sévères : 89,2 % versus aucune/légère : 87 %)(18). De plus, l’analyse du sous-groupe de patients diabétiques, a montré des résultats cohérents et durables avec ELUVIA™ comparativement au Zilver® PTX® avec 87,4 % versus 80,2 % de perméabilité primaire à 1 an, respectivement(19). Enfin, les données d’IMPERIAL sont disponibles concernant 50 longues lésions fémoropoplitées d’une longueur moyenne de 162,8 mm. Gray rapportait un taux de perméabilité primaire de 87,9 % à 1 an (estimation Kaplan Meier)(20).Il est intéressant de noter que ces données sont conformes au registre des lésions fémoropoplitées longues traitées par ELUVIA™et publiées par l’équipe de Münster(21). Dans ce registre, 49 longues lésions fémoropoplitées d’une longueur moyenne de 20 cm étaient traitées avec ELUVIA™. À 1 an, le taux de perméabilité primaire était de 87 % (estimation Kaplan Meier).
En décembre 2018, une métaanalyse a montré un signal de mortalité tardive avec certains dispositifs recouverts de paclitaxel par rapport aux dispositifs nus(22).
Il est important de noter que le stent ELUVIA™ n’était pas inclus dans cette métaanalyse. La Food and Drug Administration (FDA) des États-Unis a organisé différentes réunions pour discuter de ces données. Une nouvelle métaanalyse a été présentée par le groupe d’experts de la FDA en juin 2019, mais ELUVIA™ ne faisait toujours pas partie de ces données. Au cours de cette réunion, des données supplémentaires ont été communiquées par Boston Scientific comparant la conception du stent actif ELUVIA™ et les stents actifs coronaires (tableau 2). Il est intéressant de noter que la conception des stents actifs périphériques et coronaires est identique en termes de polymère et que la concentration de paclitaxel est plus élevée dans le stent actif coronaire.
Plus de 4 000 patients étaient inclus dans des essais cliniques randomisés en coronaires comparant le stent à élution de paclitaxel aux stents nus. Au cours de ces études, aucun signal de mortalité, toutes causes confondues, n’a été observé (figure 3). Compte tenu d’une conception très proche entre ELUVIA™ et le stent coronaire à élution de paclitaxel, l’absence de signal de mortalité en coronaire n’est pas en faveur d’un effet systémique du paclitaxel en périphérique.
Figure 3 : Stent coronaire à élution versus stent nu (BMS).
Boston Scientific a mis au point le plus vaste programme clinique concernant les traitements à élution médicamenteuse pour l’AOMI. Par exemple, l’étude randomisée EMINENT recrute actuellement 750 patients et compare les endoprothèses ELUVIA™ aux stents nus pour des lésions fémoropoplitées. De plus, afin de rechercher la survenue d’effets indésirables à long terme, les suivis d’IMPERIAL et d’EMINENT ont été étendus à 5 ans. Enfin, l’étude SPORTS, initié par un investigateur, est une étude randomisée à 3 bras, incluant un total de 222 patients et comparant le stent nu, ELUVIA™ et un ballonnet revêtu de paclitaxel (SeQuent® Please, B Braun) pour les lésions fémoropoplitées.
L’ensemble de ce programme clinique associé aux autres études concernant les dispositifs actifs devrait fournir aux praticiens les données de sécurité du patient et faciliter la prise de décisions dans le traitement des lésions fémoropoplitées.
Conclusion
L’étude IMPERIAL a permis de valider l’intérêt du stent à libération de paclitaxel contrôlée par un polymère par rapport au stent actif sans polymère. La conception, le faible dosage de paclitaxel et les données cliniques d’ELUVIA™ en font actuellement une excellente solution pour la prise en charge des patients atteints d’AOMI.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :