Cardiologie interventionnelle
Publié le 18 mai 2014Lecture 7 min
Prévention des complications hémorragiques en angioplastie
N. MENEVEAU, Pôle Cœur-Poumon, hôpital Jean-Minjoz, Besançon
Les progrès techniques et les avancées médicamenteuses accomplis au cours de ces dernières années ont conduit à améliorer de façon spectaculaire le pronostic des patients soumis à une angioplastie coronaire, en particulier ceux pris en charge dans le cadre d’un syndrome coronaire aigu.
L’efficacité accrue des antithrombotiques a permis de réduire les événements cardiovasculaires ischémiques au prix d’une majoration significative du risque hémorragique. Il est aujourd’hui bien établi que ces complications hémorragiques ont un impact pronostique majeur et justifient une prévention attentive.
L’évaluation de la fréquence et de l’impact pronostique des saignements a longtemps été sous-estimée. Les multiples définitions utilisées d’une étude à l’autre ont rendu difficile la comparaison du profil de sécurité des différentes molécules antithrombotiques utilisées dans l’angioplastie. Le recours à la définition BARC (Bleeding Academic Research Consortium) a récemment standardisé ces événements hémorragiques afin d’homogénéiser l’analyse des futurs essais conduits en pathologie cardiovasculaire (tableau 1).
Incidence des complications hémorragiques dans l’angioplastie
Le taux de complications hémorragiques varie en fonction de la définition utilisée, du contexte clinique, mais également de la nature et de la posologie du traitement antithrombotique prescrit. Les données de la littérature font état d’un taux de saignements variant entre 1 et 8% des procédures d’angioplastie. En moyenne, le chiffre de 2% d’accidents hémorragiques est le plus souvent rapporté. Ce taux est toutefois probablement sous-estimé.
À titre d’exemple, le taux de complications hémorragiques majeures dans STEEPLE était de 2% après angioplastie élective, mais de 5,4% et 6,6% après angioplastie conduite dans le cadre d’un syndrome coronaire aigu ST- et ST+ dans les études ACUITY et HORIZONS, respectivement. De la même façon, l’avènement du prasugrel et du ticagrelor est associé à une majoration de l’ordre de 20% des complications hémorragiques majeures après angioplastie. À l’inverse, dans l’étude REPLACE, la bivalirudine se distingue par une réduction des saignements de près de 40% comparée à l’association héparine non fractionnée-anti-GPIIb/IIIa, pour une efficacité antithrombotique équivalente.
L’âge avancé (≥ 75 ans), un poids corporel ≤ 60 kg, le sexe féminin, un tabagisme actif, une hyperleucocytose, la présence d’une insuffisance rénale ou d’une anémie sont autant de facteurs prédictifs de survenue d’une complication hémorragique au décours d’une procédure d’angioplastie. S’y associent un certain nombre de variables périprocédurales telles que le recours aux anti-GPIIb/IIIa, une durée de procédure ≥ 1 heure, le retrait du désilet plus de 6 heures après la fin de la procédure, la prise en charge du patient en unité de soins intensifs ou la mise en place d’un ballon de contre-pulsion intra-aortique. Des scores ont été développés pour prédire le risque de survenue d’une complication hémorragique per- ou postangioplastie, limités toutefois aux procédures conduites par voie fémorale.
Impact pronostique des complications hémorragiques au décours de l’angioplastie
La survenue d’une complication hémorragique au décours de l’angioplastie est associée à une mortalité à 1 mois multipliée par 5, comme a pu le montrer l’analyse poolée des données du registre OASIS, et des études OASIS 2 et CURE (figure 1). Le risque de décès est majoré au cours de l’hospitalisation, mais également à distance de celle-ci. Il existe en effet une relation étroite et pérenne dans le temps entre hémorragie hospitalière et mortalité à 1 an, chez les patients ayant un syndrome coronaire aigu pris en charge en angioplastie dans l’étude ACUITY (figure 2). Si les hémorragies les plus sévères sont associées à un risque de mortalité plus élevé, il ne faut pas négliger l’impact pronostique des saignements mineurs trop souvent sous-estimé.
Figure 1.
Figure 2.
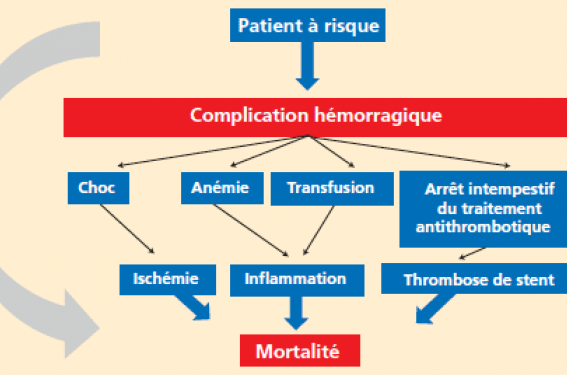
Différents mécanismes interviennent dans le risque de sur-mortalité observé après saignement. L’arrêt intempestif du traitement antithrombotique peut être responsable de thromboses de stent et d’infarctus. La survenue d’un choc hémorragique majore le risque d’ischémie myocardique, alors que l’anémie et les transfusions sanguines sont à l’origine d’une réaction inflammatoire susceptible d’augmenter le risque de thrombose de stent par le biais de l’activation plaquettaire (figure 3).
Figure 3.
Comment prévenir les complications hémorragiques de l’angioplastie ?
Prévenir les complications hémorragiques de l’angioplastie est devenu un véritable enjeu thérapeutique. Pour y parvenir il convient de mettre en œuvre un certain nombre de précautions.
Éviter les surdosages...
En premier lieu les surdosages des différents traitements antithrombotiques doivent être recherchés et évités. Ils sont responsables d’approximativement 15% des complications hémorragiques graves.
Les facteurs prédictifs de surdosage médicamenteux sont les mêmes que ceux associés aux saignements eux-mêmes. Les patients de sexe féminin, de faible poids, ceux souffrant d’insuffisance rénale, de diabète ou d’insuffisance cardiaque sont ainsi plus fréquemment exposés à une complication hémorragique par le biais d’un surdosage médicamenteux.
Le fondaparinux, les héparines de bas poids moléculaire, l’hirudine, l’argatroban, la bivalirudine et les anti-GPIIb/IIIa ont tous une élimination essentiellement rénale et doivent à ce titre ne pas être utilisés en cas d’insuffisance rénale sévère (clairance de la créatinine < 30 ml/min), ou faire l’objet d’un ajustement posologique. Si l’héparine non fractionnée demeure l’anticoagulant de choix dans ce contexte, elle est malgré tout associée à une majoration du risque hémorragique, proportionnelle à la dégradation de la fonction rénale.
...et les changements d’anticoagulant
De la même façon, le changement d’anticoagulant est associé à un risque accru de saignement. Dans l’étude SYNERGY, les patients avec syndrome coronaire aigu soumis à une angioplastie étaient randomisés pour recevoir de l’héparine non fractionnée ou de l’énoxaparine. Près de 75% d’entre eux avaient reçu un traitement anticoagulant en amont de la randomisation. Une majoration très nette des complications hémorragiques était observée chez les 8% de patients contraints à un changement de traitement anticoagulant. La règle est donc de s’abstenir de substituer un traitement anticoagulant à un autre, particulièrement si ce changement concerne l’héparine non fractionnée et les héparines de bas poids moléculaire.
La durée du traitement anticoagulant doit par ailleurs être la plus courte possible. À l’exception des situations à haut risque thrombotique, les anticoagulants doivent être interrompus au décours de l’angioplastie.
Privilégier les antithrombotiques les plus sûrs d’utilisation
Le choix des agents antithrombotiques est également très important et doit se porter sur les molécules dont l’efficacité et la sécurité d’emploi ont pu être établies à partir d’études randomisées. L‘usage de bivalirudine est ainsi recommandé dans l’angioplastie primaire (étude HORIZONS) ou chez les patients avec syndrome coronaire aigu ST- soumis à angioplastie (étude ACUITY), en raison d’un taux de complications hémorragiques inférieur à celui de l’association héparine non fractionnée-anti-GPIIb/IIIa.
Dans HORIZONS, la réduction du risque hémorragique était associée à une baisse de la mortalité cardiovasculaire et globale à 1 mois, qui se maintenait à 3 ans. Le recours aux anti-GPIIb/IIIa ne se conçoit qu’en situation d’urgence en salle de cathétérisme et ne doit plus être envisagé en amont de la coronarographie dans l’immense majorité des cas. Enfin, l’administration d’un bolus IV unique d’énoxaparine s’est montrée plus efficace dans l’angioplastie primaire que le traitement conventionnel par héparine non fractionnée, sans majoration des complications hémorragiques.
Privilégier la voie radiale
Prévenir les complications liées à l’abord vasculaire est essentiel, puisqu’elles sont responsables de deux tiers des hémorragies survenant au décours de l’angioplastie. L’usage de dispositifs de fermeture artérielle fémorale n’a pas fait la preuve de son efficacité à réduire les complications hémorragiques, comparé à la compression manuelle. Le recours à des introducteurs de taille réduite, le retrait précoce de l’introducteur (< 6 heures) et l’usage préférentiel de l’abord radial sont en revanche associés à une réduction nette des complications hémorragiques.
L’étude RIVAL, qui comparait les abords radial et fémoral, a montré une réduction des complications vasculaires avec la voie radiale associée à un bénéfice clinique certain chez les patients pris en charge pour un infarctus et dans les centres privilégiant cette approche. Les complications hémorragiques gastro-intestinales constituent 50% des saignements spontanés de la phase aiguë des syndromes coronaires aigus et justifient la prescription d’inhibiteurs de la pompe à protons (IPP) chez les patients aux antécédents d’hémorragie digestive ou d’ulcère.
Le problème du traitement concomitant par les anticoagulants oraux
Le problème des patients sous traitement anticoagulant (AVK) pris en charge en urgence pour un syndrome coronaire aigu est en revanche loin d’être éludé. Le recours à une double antiagrégation plaquettaire ne saurait être remis en cause, mais le clopidogrel doit être préféré au prasugrel ou au ticagrelor en raison d’un risque hémorragique moindre. La durée optimale de la triple association est à considérer au cas par cas, en fonction de la pathologie associée (maladie thromboembolique veineuse, fibrillation auriculaire, prothèse valvulaire mécanique) et du niveau de risque thrombotique du patient. Dans tous les cas, l’implantation d’un stent « nu » sera privilégiée à celle d’un stent « actif ».
Ce qu’il faut retenir
L’évaluation du risque hémorragique est un élément déterminant de la prise en charge des patients soumis à une angioplastie.
Le traitement antithrombotique doit être déterminé en fonction du niveau de risque hémorragique du patient et la posologie adaptée au poids et à la clairance de la créatinine.
Le remplacement d’un traitement anticoagulant par un autre doit être évité, en particulier si ce remplacement concerne l’héparine non fractionnée et l’énoxaparine.
Le traitement antithrombotique doit être interrompu à l’issue de la procédure dans la majorité des cas et l’usage des anti-GPIIb/IIIa ne pas être instauré en amont de la salle de coronarographie.
Enfin, l’abord radial doit être privilégié au détriment de l’abord fémoral, particulièrement pour les patients pris en charge pour un infarctus.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :