Publié le 22 fév 2015Lecture 7 min
Pourquoi faire des angioplasties d’occlusions coronaires chroniques et avec quels résultats ?
H. BENAMER, T. LEFÈVRE, T. HOVASSE, K. HAYASHIDA et Y. LOUVARD, Institut Cardiovasculaire Paris-Sud, Massy
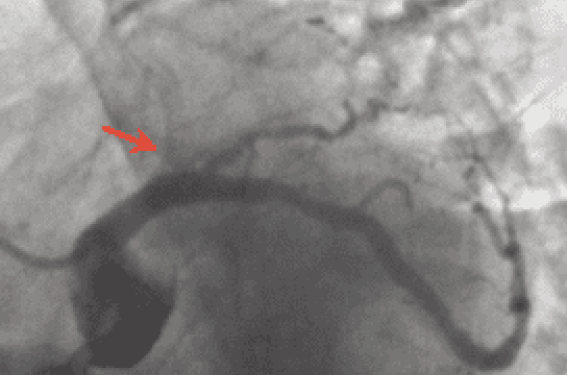
Selon le consensus de l’European CTO Club une occlusion chronique (CTO) est une occlusion coronaire totale, TIMI 0 (sans flux coronaire antérograde), datant de plus de 3 mois(1). Si l’ancienneté « clinique » ne peut être affirmée, des critères angiographiques peuvent témoigner de l’ancienneté de l’occlusion : présence de collatérales bien développées, pas de stagnation du produit de contraste.
Jusqu’à récemment, l’angioplastie des CTO était généralement considérée dans notre pratique quotidienne comme inutile, difficile, coûteuse, voire dangereuse. Ces lésions coronaires étant par définition stables, les options thérapeutiques sont longtemps restées très prudentes. Ainsi, les occlusions anciennes monotronculaires, même à fonction VG normale avec ischémie documentée, ont longtemps été traitées médicalement tandis que les lésions tritronculaires avec une occlusion chronique étaient traitées par chirurgie de pontage.
Des lésions fréquentes
Ces lésions ne sont pas rares. Parmi les patients présentant une suspicion de cardiopathie ischémique et bénéficiant d’une coronarographie, la fréquence des CTO est de l’ordre de 30 % et augmente avec l’âge. Dans les CTO, le collagène est la composante principale de la matrice extracellulaire, et la concentration de tissu riche en fibres collagènes est importante dans la partie proximale et distale (figure 1)(2). Il existe aussi d’importantes calcifications, une inflammation et une néovascularisation. Le scanner coronaire permet parfois d’apporter des informations très intéressantes sur les calcifications permettant de préciser la stratégie thérapeutique (figure 2). Aujourd’hui, la plupart des patients qui font l’objet d’une tentative de désobstruction sont symptomatiques, avec le plus souvent un angor stable(3). Les antécédents d’infarctus sont alors très fréquents, retrouvés dans plus de 40 % des cas. Pour les patients diabétiques, l’ischémie myocardique silencieuse est plus fréquente. Dans tous les cas, la désobstruction doit être discutée seulement s’il existe une ischémie documentée sur plus de 2 à 4 segments et/ou une viabilité de plus de 25 à 50 % du territoire considéré.
Figure 1.
Figure 2.
Pourquoi les traiter par angioplastie ?
Nous ne disposons pour l’instant que d’arguments indirects en faveur de la désobstruction des CTO. En effet, toutes les études comparent le devenir des patients en fonction d’un échec ou d’un succès de désobstruction et non pas sur la base d’une étude randomisée portant chez des patients ayant une viabilité et ou ischémie documentée. La première étude randomisée, proposée par l’Euro CTO Club et portant sur un grand nombre de patients, est en cours de mise en place. Les arguments indirects en faveur de la désobstruction des CTO se sont accumulés au fil du temps et sont nombreux : amélioration de l’angor(4), de l’ischémie, de la fonction VG(5), de la nécessité d’un pontage ultérieur et surtout de la mortalité(6) en cas de succès de la désobstruction par rapport à un échec (figure 3). Par ailleurs, la survenue d’un infarctus du myocarde chez un patient présentant une occlusion coronaire chronique (lésion non coupable de l’infarctus) conduit à un triplement de la mortalité- (figure 4), à une plus grande fréquence de survenue d’un choc cardiogénique et à une plus grande élévation des marqueurs biologiques de nécrose par rapport à des patients ne présentant pas de CTO. Ainsi, le mauvais pronostic de l’atteinte pluritronculaire en cas d’infarctus n’est pas lié à l’atteinte pluritronculaire per se, mais à la présence d’une CTO associée.
Figure 3.
Figure 4.
Enfin, l’accumulation des connaissances et de l’expérience dans ce domaine, sous l’impulsion des équipes japonaises, a permis d’améliorer la sécurité et le taux de succès de ces procédures complexes, tandis que l’apparition des stents actifs a permis de réduire de manière spectaculaire le risque de resténose et de réocclusion.
Ainsi en 2011, une tentative de désobstruction peut être proposée pour traiter des symptômes, pour améliorer le pronostic à long terme si le territoire est vaste et améliorer la fonction ventriculaire gauche, ce qui implique dans toutes ces situations l’existence d’une viabilité myocardique dans le territoire concerné et le plus souvent d’une ischémie myocardique démontrée. Ainsi, l’évaluation de la viabilité myocardique et la recherche de l’ischémie sont des éléments indispensables. Elle peut être attestée par l’absence d’ondes Q à l’ECG, une cinétique préservée du territoire considéré sur l’échographie ou la ventriculographie ou enfin une étude plus fine de viabilité et/ou d’ischémie par scintigraphie, échographie de stress ou d’effort ou encore l’IRM qui semble être aujourd’hui l’examen le plus précis.
Aspects techniques
La qualité de la coronarographie avant de définir la stratégie d’angioplastie de la CTO est essentielle. Plusieurs incidences doivent être acquises avec des injections longues afin de visualiser l’artère occluse, son lit d’aval et les connexions avec le réseau collatéral. Lors de l’angioplastie, une injection bilatérale est souvent la seule manière de connaître la longueur de la lésion (souvent plus courte que prévue) et de visualiser la progression pas à pas du guide en bonne position dans le lit d’aval.
L’approche antérograde est la plus courante, et de nombreuses astuces sont venues récemment parfaire cette technique (guides effilés adaptés au cheminement dans les micro-canaux, microcathéters, « parallel wire » lorsque le premier guide est positionné en fausse lumière...). L’approche rétrograde consiste à aborder l’occlusion chronique par la partie distale, généralement moins dure que la proximale en passant par les artères septales (le plus souvent) et parfois par les collatérales épicardiques. Le franchissement de l’occlusion par un guide ne signifie pas toujours un succès. La prédilatation peut s’avérer très difficile, voire impossible. Le Rotablator est parfois nécessaire pour permettre le franchissement et la dilatation au ballon.
D’autres méthodes peuvent être très utiles (laser, cathéter, tournus...). Enfin, les stents doivent être actifs, correctement déployés et bien apposés à la paroi, car le risque de resténose est important pour ce type de lésion.
Résultats
Avec l’évolution du matériel, des techniques, de l’entraînement des opérateurs et des équipes, le risque d’échec a considérablement diminué et les anciens facteurs prédictifs d’échec (ancienneté de la lésion, présence d’une branche de division...) ont changé.
Aujourd’hui, les chances de succès dépendent surtout des caractéristiques de la lésion (longueur, calcifications, tortuosités) et de l’expérience de l’opérateur et de l’équipe (tableau). De nombreuses équipes japonaises dépassent 90 % de succès sur des cas non sélectionnés. Dans notre expérience, basée sur un registre prospectif de 1 000 patients inclus entre 2004 et 2009, l’âge moyen était de 63 ans ± 12 ans, 27 % des patients étaient diabétiques et 21% avaient des antécédents d’infarctus du myocarde. Il s’agissait d’une 2e tentative dans 7 % des cas. L’ancienneté de la lésion était de 21 mois ± 42 mois et la longueur de 21 mm ± 17 mm, tandis qu’un aspect de « bridging collaterals » était retrouvé dans 37 % des cas. Le taux de succès sur ces lésions complexes était de 70 % (67,9 % en 2004 et 73,2 % en 2009). La quantité de produit de contraste de 279 cc ± 176 cc et la durée de la procédure de 85 min ± 46 min avec un taux de complications intrahospitalières (MACCE) de moins de 3 %.
Dans notre expérience, les facteurs prédictifs d’échec étaient par ordre croissant : l’absence de moignon, des antécédents de pontage, l’importance des calcifications, l’expérience de l’opérateur (nombre de CTO réalisées) et la longueur de l’occlusion (2 % d’échec par millimètre d’occlusion supplémentaire).
Tableau.
Limites
Ces procédures complexes se compliquent parfois. La perforation coronaire peut être en rapport avec une effraction réalisée avec le guide d’angioplastie ou une rupture d’artère par le ballon. Ce type de complication est devenu exceptionnel grâce à la visualisation systématique de la bonne position du guide par injection controlatérale. Selon les cas, elle sera traitée par des inflations prolongées du ballon avec antagonisation de l’héparine, injection de « coils », mise en place d’un stent couvert. Un kit de drainage péricardique percutané doit toujours être à portée (ce qui est vrai pour toute angioplastie). Cela souligne l’importance de mettre en place une équipe dédiée pour les centres qui s’intéressent à cette approche techniquement demandeuse. L’insuffisance rénale liée à la quantité de contraste injectée est une complication qu’il faut tenter de prévenir en se fixant une dose limite de contraste (le risque apparaît à partir de 4 fois le chiffre de la clairance et augmente considérablement au-delà de 8 fois). Il est augmenté chez le diabétique. La préparation optimale du patient est cruciale (alcalinisation, hydratation...). Le problème de l’irradiation bien qu’encore mal évalué est certain, avec des doses délivrées qui sont souvent importantes. Les conséquences peuvent être des lésions cutanées pouvant aller jusqu’à la nécrose. Des moyens existent pour réduire les doses : travailler table haute et ampli ou capteur bas, en évitant d’utiliser les champs trop petits, en collimatant, en évitant certaines incidences, avec une cadence d’image basse, et en changeant d’incidence très régulièrement.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :