Cardiopathies congénitales
Publié le 14 jan 2016Lecture 5 min
Quand fermer le foramen ovale perméable ?
M. BARBIEUX-GUILLOT, V. SATTLER, F. CHOLLET, Unité neuro-vasculaire, hôpital Pierre-Paul Riquet, CHU de Toulouse
À l’heure actuelle, environ 30 % des AVC ischémiques (AI) (infarctus cérébraux et AIT) restent sans étiologie déterminée à l’issue d’un bilan étiologique exhaustif(1). La population des AI la plus concernée par ces AI cryptogéniques est la population du sujet « dit jeune », de moins de 55 ans, voire de moins de 45 ans, chez lequel la prévalence des facteurs de risque cardiovasculaires classiques, donc de l’athérome et de la fibrillation atriale, est moindre que chez les patients plus âgés. Au sein de ces AI cryptogéniques, environ 40 % présentent un foramen ovale perméable (FOP), ce qui est une prévalence bien supérieure à celle de 25 % dans la population générale.
L’association non fortuite entre FOP et AI est connue depuis plus de 25 ans et elle est d’autant plus forte que le FOP est associé à un anévrisme du septum interauriculaire (ASIA), que le shunt droite-gauche est important et que le FOP est large(2). Cependant, le mécanisme physiopathologique liant le FOP avec un AI reste obscur. Même si le mécanisme le plus souvent avancé reste l’embolie paradoxale de thrombi d’origine veineuse dans la circulation systémique artérielle, une source veineuse est rarement mise en évidence. Les autres mécanismes potentiels seraient la survenue d’épisodes de fibrillation atriale (FA) paroxystique ou l’embolie de thrombi se formant directement dans le tunnel du FOP ou de l’ASIA associé. Mais il existe peu ou pas de preuve de ces derniers mécanismes(3). Une dernière hypothèse serait la présence d’une cause occulte associée au FOP, comme l’est la migraine.
La question de l’imputabilité du FOP dans la genèse d’AI n’est pas aisée puisque 25 % de la population générale est porteuse d’un FOP. Par conséquent, un patient victime d’AI peut tout à fait être porteur d’un FOP fortuitement et présenter une ou plusieurs autres causes d’AI. En effet, Alsheikh-Ali et coll. ont estimé, au vu de la prévalence des AI cryptogéniques et de la prévalence du FOP, qu’au sein de la population d’AI cryptogéniques, 50 % des FOP découverts seraient non liés à l’AI(4). Par conséquent, le Risk of Paroxysmal Embolism (RoPE) a identifié les facteurs de risque de découverte d’un FOP dans le cadre d’un AI et les a regroupés dans un score sur 10 points, comprenant l’âge jeune, la présence d’un infarctus cérébral cortical en imagerie et l’absence d’AI précédent, de tabagisme, de diabète ou d’hypertension artérielle(5) (tableau 1). Ce score voit la prévalence du FOP passer de 23 % en cas de score RoPE inférieur ou égal à 3, à 73 % en cas de score RoPE à 9. En parallèle, la fraction d’AI imputable au FOP passe de 0 % en cas de score RoPE inférieur à 3, à 88 % en cas de score RoPE à 9. Mais l’incidence d’un nouvel AI dans les 2 ans diminue avec le score RoPE, passant de 20 % en cas de score RoPE inférieur à 3, à 2 % en cas de score RoPE à 9 (tableau 2). Ceci semblerait lié à la présence d’autres étiologies d’AI que le FOP plus fréquente et, de ce fait, de plus grand risque de récidive en cas de score RoPE faible.
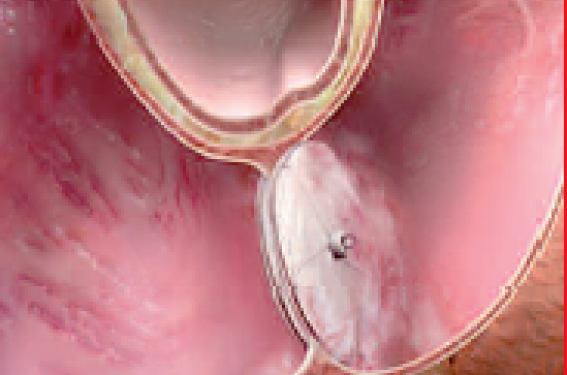
La question de la prévention secondaire de ces AI liés au FOP se pose donc tout naturellement. La première question est bien sûr d’éliminer toute autre cause d’AI, ayant donc un risque de récidive d’AI significativement plus important qu’un FOP et une prévention secondaire clairement établie (par exemple, anticoagulation curative en cas de FA ou antiagrégation et gestion optimale des facteurs de risque en cas d’athérome). Si la question du choix thérapeutique semble simple en cas de thrombophilie veineuse associée au FOP ou d’une stase intracardiaque importante, justifiant d’un traitement anticoagulant au long cours, celleci est beaucoup plus complexe dans la plupart des autres cas. La fermeture du FOP est une procédure qui s’est développée il y a plusieurs années, espérant diminuer le risque de récidive d’AI et de conséquences iatrogènes des traitements antithrombotiques.
Mais cette procédure présente un risque de complications initiales potentielles graves (perforation cardiaque avec ou sans tamponnade, migration de matériel, embolie gazeuse, hématome au point de ponction, arythmie, thrombose et AI)(6) et de complications au long cours à type de fibrillation atriale et d’érosion septale(7).
À ce jour, trois essais randomisés ont comparé la fermeture de FOP versus traitement antithrombotique (aspirine ou antivitamine K à la discrétion des investigateurs) : CLOSURE I(8), PC Trial(9) et RESPECT(10). Chacun de ces trois essais n’a pas montré de différence significative entre traitement médical et fermeture du FOP sur la récurrence d’AI. Les métaanalyses ne permettent pas non plus de mettre en évidence de différence significative de récurrence d’AI entre les deux attitudes thérapeutiques (RR = 0,66 ; IC95% : 0,37-1,9 ; p = 0,17) ni sur le risque hémorragique, mais il existe un sur-risque de survenue de fibrillation atriale (RR = 3,6 ; IC95% : 1,43-9,34 ; p = 0,007)(3,11,12). Il semble néanmoins exister un meilleur profil de tolérance pour le dispositif Amplatzer par rapport au STARFlex(11). L’absence d’effet en prévention secondaire dans ces essais peut être lié à des critères variables d’inclusion et de définition de l’AI cryptogéniques avec inclusion de patients présentant des AI non liés à des FOP mais à une autre étiologie puisque la prévalence des facteurs de risque cardiovasculaires étaient la même que celle de la population générale des AI. De plus, le groupe contrôle comprenait des patients traités par antiagrégant ou par AVK, dont on ne sait pas s’il existe une équivalence sur l’efficacité en prévention d’AI liés au FOP. Ces essais manquaient de puissance puisque le taux d’incidence d’AI était plus faible qu’attendu à 1,3 %/an.
Finalement, il semble exister peu de place pour la fermeture de FOP en prévention secondaire d’AI à l’heure actuelle selon les données de la littérature. Cependant, en cas d’AI lié à un FOP, après avoir éliminé les autres causes plus classiques nécessitant un traitement spécifique, la HAS a émis des recommandations en juillet 2014, mises à jour en février 2015(13).
En première intention, en prévention secondaire d’AI associé à un FOP, un traitement antithrombotique est recommandé (avis d’expert), avec en première intention, un traitement antiagrégant plaquettaire : aspirine 75 à 325 mg ou clopidogrel 75 mg.
En cas de pathologie thromboembolique veineuse concomitante, un traitement anticoagulant est recommandé (avis d’expert). Au vu des résultats des essais randomisés disponibles, la fermeture de FOP n’est pas recommandé chez les patients ayant un premier AI associé à un FOP (grade B). La fermeture de FOP peut être envisagé, après concertation neurocardiologique, chez les patients âgés de moins de 60 ans présentant un AI de cause indéterminée, récidivant sous traitement antithrombotique bien conduit (avis d’expert). En dehors de ces rares cas, ces patients doivent être, autant que possible, inclus dans les essais thérapeutiques en cours CLOSE (ClinicalTrials.gov, NCT00562289), DEFENSE-PFO (NCT01550588) et REDUCE (NCT00738894). Une métaanalyse de l’ensemble des essais de prévention secondaire d’AI par fermeture de FOP pourrait permettre de répondre clairement à la question posée : quand fermer le foramen ovale perméable ?
Les auteurs déclarent n’avoir aucun conflit d’intérêts en rapport avec cet article.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :