Rythmologie et rythmo interventionnelle
Publié le 15 mai 2017Lecture 7 min
Conduite à tenir devant des extrasystoles ventriculaires « Ce n’est rien ou je risque de mourir docteur ? »
Nicola LELLOUCHE, David HAMON, Service de cardiologie, rythmologie, Hôpital Henri Mondor, Créteil
Les extrasystoles ventriculaires (ESV) sont un trouble du rythme très fréquent. On estime que 50 % de la population totale présente au moins 1 ESV si on réalise un Holter ECG systématique de 24 heures dans une population âgée d’au moins 50 ans. Cependant, cette prévalence tombe à 1-4 % si on considère les patients avec des ESV > 60/h(1). La présence d’ESV n’est pas forcément considérée comme une pathologie, notamment chez des patients avec de très rares ESV et sans aucune maladie cardiaque sous-jacente. Ainsi, on estime qu’il existe un sur-risque cardiovasculaire au-dessus de 10 ESV/h au Holter ECG des 24 heures(2). Cette limite est arbitraire mais peut être utilisée pour débuter un bilan à la recherche d’une cardiopathie sous-jacente(2). Concernant le risque de mort subite, la présence d’une cardiopathie sous-jacente est un critère pronostique majeur de sur-risque chez un patient présentant des ESV. Cependant, même si le pronostic des patients présentant des ESV sur coeur sain est bon, il est important de noter que certains de ces patients peuvent présenter une mort subite ou développer une cardiomyopathie induite par les ESV. Enfin, les indications de traitement, et particulièrement de l’ablation, se sont élargies et pourront possiblement s’élargir encore plus dans l’avenir.
Rechercher une cardiopathie sous-jacente
Sachant que le pronostic des ESV est lié principalement à la présence d’une cardiopathie sous-jacente, il est fondamental d’explorer les patients présentant une extrasystolie ventriculaire significative (> 10 ESV/h). Pour aiguiller sa recherche, il convient d’essayer de localiser la partie du cœur d’où provient l’ESV (figure 1). Ainsi, si l’ESV provient du ventricule droit, un bilan de cardiopathie du cœur droit, et particulièrement de dysplasie arythmogène du ventricule droit (DAVD) doit être effectué. Ce bilan consiste en la réalisation d’une ETT, une IRM cardiaque et éventuellement une scintigraphie de phase du VD, ainsi qu’une angiographie du VD. Si l’ESV provient du ventricule gauche, une recherche de cardiopathie hypertensive, ischémique, valvulaire ou de cicatrice de myocardite est nécessaire. Ainsi, on réalisera une ETT, un test d’effort avec éventuellement une coronarographie. À noter aussi l’intérêt de l’IRM cardiaque qui peut révéler de petites zones cicatricielles du ventricule gauche (cicatrice d’infarctus ou de myocardite aiguë) non visible à l’ETT. Une étude récente a montré que 85 % des patients présentant des ESV d’effort sur coeur apparemment sain présentaient des anomalies à type d’anomalie péricardique ou de cicatrice de myocardite(3).
Certains signes électrocardiographiques des ESV sont aussi assez évocateurs d’une cardiopathie sous-jacente associée : QRS larges, ESV polymorphes, aspect crocheté des QRS sur l’ESV. De plus, il est important de noter que le couplage court (< 400 ms) de l’ESV est un élément important, associé à la survenue de TDR ventriculaires graves. L’apparition ou aggravation des ESV à l’effort est considérée comme un signe de mauvais pronostic associé à une cardiopathie sousjacente(4). Enfin, si le bilan diagnostique est négatif, on parlera d’ESV sur cœur sain. Le pronostic de ces patients est meilleur que celui des patients présentant une cardiopathie sous-jacente mais n’est pas complètement bénin, dépendant du type de l’ESV(5).
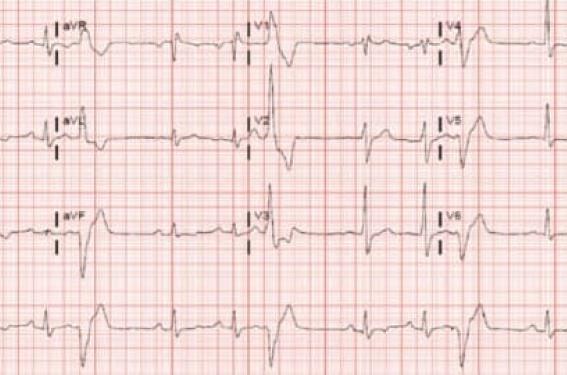
Figure 1. A : ESV trigéminées (1 ESV pour 2 QRS spontanés). Pour localiser l’ESV, regarder la polarité en V1 qui ici est négative, donc l’ESV vient du ventricule droit (aspect de retard gauche). Par ailleurs les QRS sont positifs en dérivations inférieures (D2, D3, Vf) ; donc ces ESV proviennent du haut du VD = infundibulum pulmonaire. B : ESV trigéminées, ESV positive en V1, donc provenant du VG (aspect de retard droit). Les ESV sont négatives dans les dérivations inférieures. Donc ces ESV proviennent de la paroi inférieure du VG.
Stratification du risque de mort subite
La présence d’ESV isolées n’est pas un critère suffisant à l’échelle de la population pour proposer une stratégie thérapeutique précise de réduction de mort subite comme l’implantation d’un DAI par exemple. Cependant, en fonction de la cardiopathie sousjacente mise en évidence, elles peuvent être le témoin d’un surrisque de mort subite chez un patient présentant une cardiopathie hypertrophique, ischémique, valvulaire…
Dans le cadre de cette stratification, la réalisation d’une stimulation ventriculaire programmée peut s’avérer nécessaire, par exemple, chez un patient présentant une DAVD ou une cardiopathie ischémique avec dysfonction VG modérée entre 35 et 40 %(2). Par ailleurs, certains patients présentant des ESV « tueuses » peuvent présenter un sur-risque de mort subite, même avec un cœur anatomiquement normal. Il s’agit typiquement d’ESV provenant du système de Purkinje, plutôt fines avec un couplage court (< 400 ms) ou variable naissant dans l’épicarde(6).
En présence d’ESV sur coeur morphologiquement sain, un événement clinique grave (syncope ou mort subite récupérée), il faut toujours rechercher une pathologie « électrique » cardiaque sous-jacente de type syndrome de Brugada, repolarisation précoce, syndrome du QT long ou court et éventuellement TV catécholergique(7). Cependant la stratification du risque rythmique chez les patients présentant des ESV reste très difficile, relevant souvent du cas par cas, en s’appuyant sur de nombreux paramètres, notamment la FEVG qui reste le marqueur le plus puissant de mort subite.
Facteurs associés à la survenue d’une cardiomyopathie induite aux ESV
Un cas particulier doit être discuté séparément, qui est celui de patients présentant une dysfonction ventriculaire gauche associée à des ESV. En l’absence d’autres causes de cardiomyopathie dilatée (CMD), cette situation pose le problème de savoir si les ESV sont secondaires à une CMD ou si ce sont les ESV qui ont pu induire cette CMD. Les caractéristiques des ESV précédemment décrites peuvent donner une orientation en faveur d’une cardiopathie sousjacente : nombre d’ESV (si faible plutôt en faveur d’une CMD sous-jacente), ESV polymorphes, largeur des QRS et aspect crochetés des ESV. L’anamnèse est aussi importante, notamment pour savoir si la dysfonction cardiaque a précédé ou pas la survenue des ESV. Cependant, tous ces indices sont imparfaits et l’histoire naturelle de la CMD induite aux ESV n’est pas clairement connue. Parfois, ce diagnostic ne peut être fait que de manière rétrospective une fois les ESV traitées, devant une amélioration de la fonction ventriculaire gauche.
On estime que 6 à 40 %(8) des patients présentant des ESV vont développer une cardiopathie induite aux ESV. À l’inverse, chez les patients ablatés pour ESV fréquentes avec dysfonction VG, 83 % vont présenter une amélioration significative (> 10 % de FEVG) après un succès d’ablation(9). Même si les études de suivi de ces patients avec ESV et cardiomyopathie manquent, plusieurs facteurs ont été associés à la survenue d’une CMD induite aux ESV :
- le caractère asymptomatique des ESV : en effet, cela est associé à un délai avant de consulter et peut expliquer la survenue de cas plus sévères(10) ;
- le nombre d’ESV : ainsi, on estime que lorsque le taux d’ESV dépasse 10-15 % sur 24 heures, ce qui correspond environ à 10 000-15 000 ESV sur 24 heures, il existe un risque accru de cardiomyopathie ;
- la largeur des QRS au cours des ESV : on estime d’au-delà de 150 ms, il existe un sur-risque de développer une cardiomyopathie(11) ;
- le caractère épicardique des ESV : il semble que les ESV naissant de la surface du coeur au niveau de l’épicarde soient plus souvent associées à un risque de CMD. La physiopathologie de cette constatation n’est pas clairement élucidée.
Cependant, chez un patient donné présentant des ESV, la valeur prédictive de chacun de ces critères pris individuellement est limitée. Ainsi, il est probable que des algorithmes intégrant plusieurs de ces paramètres soient nécessaires(12) pour pouvoir mieux le prédire et traiter au mieux les patients qui risquent de développer une CMD.
Traitement des ESV
L’indication du traitement des ESV doit d’abord se faire sur le caractère symptomatique de ces ESV, qui peuvent parfois être très gênantes, même en étant peu nombreuses. L’autre indication de traitement dépend de la présence d’une dysfonction ventriculaire gauche qui va pousser à essayer de faire disparaître ces extrasystoles dans le but d’améliorer la fonction cardiaque. Une zone d’ombre concerne les patients asymptomatiques et présentant un nombre d’ESV important pouvant par la suite développer une CMD.
De toute façon, si l’ESV révèle une cardiopathie sous-jacente, il convient systématiquement de traiter cette cardiopathie : ischémique, valvulaire, hypertensive, etc.
De façon plus spécifique, un traitement antiarythmique peut être prescrit :
- le traitement bêtabloquant est le traitement de choix surtout chez les patients présentant une aggravation de leurs ESV à l’effort(13) ;
- sinon, les antiarythmiques de classe Ic : flécaïnide, propafénone, etc. sont souvent efficaces dans les cas d’ESV sur coeur sain ou dans la DAVD ;
- l’amiodarone reste le traitement de choix en cas de dysfonction VG, mais sa prescription au long cours doit être réfléchie du fait de ses nombreux effets secondaires, surtout chez les patients jeunes.
Ainsi, l’ablation est une excellente alternative aux traitements antiarythmiques(2) au long cours ou lorsque ceux-ci ne fonctionnent pas. Il est possible de s’aider d’une imagerie préopératoire pour évaluer la présence possible de cicatrice myocardique, qui serait la zone d’origine des ESV. Les taux de succès de l’ablation des ESV est de l’ordre de 70-80 % avec une absence de récidive au long cours dans la majorité des cas. Cependant, cette intervention est d’autant plus difficile que le nombre de foyers d’ESV est important et donc que la cardiopathie sous-jacente est sévère.
Figure 2. A : ESV bigéminées (1 ESV pour 1 QRS spontané). ESV plutôt négative en V1, mais avec onde R présente puis devenant positive en V2. Il s’agit plutôt d’une origine septale. Elles sont positives en inférieures donc plutôt infundibulaires droite ou gauche. B : À noter une pente d’ascension de l’ESV lente = 84 ms sur une largeur du QRS de 108 ms (84/108 = 78 % ; si ce ratio est > 55 % c’est en faveur d’une origine épicardique de l’ESV). C : Après mapping, il s’agit d’une ESV épicardique infundibulaire gauche ablatée au fond du sinus coronaire. Disparition des ESV au début du tir au fond du sinus coronaire. Pas de récidive après l’ablation.
En pratique
Les extrasystoles ventriculaires sont un trouble du rythme fréquent.
Le pronostic de ces ESV dépend essentiellement, dans l’immense majorité des cas, de la cardiopathie sous-jacente.
Les patients sans cardiopathie sous-jacente ont globalement un bon pronostic. Il convient de les traiter si le patient est symptomatique et/ou s’il existe une dysfonction ventriculaire gauche sous-jacente.
Au-delà de 10 000 ESV/24 heures chez un patient asymptomatique, un suivi cardiologique rapproché s’avère nécessaire pour dépister précocement la survenue d’une dysfonction VG et traiter au mieux le patient.
Le traitement antiarythmique médicamenteux reste le traitement de première intention, mais l’ablation est une alternative qui peut s’avérer particulièrement efficace, notamment pour éviter le risque d’effets secondaires médicamenteux.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :