Publié le 26 sep 2017Lecture 9 min
Angioscanographie et angiographie par résonance magnétique - Avantages et inconvénients
Francesco MACRI, Ahmed LARBI, Julien FRANDON, Cornelia FREITAG, Nicolas MENJOT DE CHAMPFLEUR, Jean-Paul BEREGI, Radiologie et imagerie médicale, CHU Caremeau, Nîmes
Voici un rappel des bases de l’angioscanographie et de l’angiographie par résonance magnétique utiles à la pratique quotidienne. Nous évoquerons également les évolutions à connaître – moins d’irradiation en scanner, les produits de contraste iodés iso-osmolaires pour les patients insuffisants rénaux, l’IRM pour les porteurs de pacemakers, etc. Enfin, le choix d’une technique par rapport à l’autre et leurs avantages et inconvénients seront précisés dans cet article.
Angioscanographie
Le rôle du scanner en pathologie cardiovasculaire devient de plus en plus central dans la prise en charge des patients au détriment de l’angiographie plus invasive, plus difficilement accessible et plus coûteuse. Le scanner permet de dépister, de diagnostiquer, d’étudier l’extension et la morphologie pré-interventionnelle de la plupart des maladies vasculaires mais aussi du cœur du fait d’évolutions technologiques majeures. Avec de nombreuses améliorations techniques comme le choix entre un mode séquentiel ou un mode spiralé, l’amélioration des détecteurs, l’augmentation du nombre de barrettes (4, 16, 32, 64, 128, 256 et 320), un temps de rotation du tube inférieur à la seconde et des reconstructions informatiques sur 180° voire 90°, l’acquisition devient de plus en plus rapide, les volumes couverts de plus en plus grands avec une amélioration des résolutions temporelle et spatiale. Une autre évolution majeure est l’apparition de la synchronisation cardiaque, utile en particulier pour l’exploration des artères coronaires, de l’aorte ascendante et des valves cardiaques.
L’ensemble de ces évolutions techniques permet de répondre à pratiquement toutes les questions en réalisant des couvertures ciblées ou des couvertures larges. Cependant, l’amélioration des possibilités du scanner repose sur la nécessité d’optimiser les protocoles d’acquisition et donc de les adapter à la pathologie suspectée et à la question posée. Le plus important pour le radiologue est d’identifier l’attente du demandeur afin de lui proposer le meilleur protocole pour orienter la prise en charge, notamment avec les dernières techniques de radiologie interventionnelle.
L’irradiation
Les inconvénients classiques du scanner sont l’irradiation et la nécessité d’injecter un produit de contraste le plus souvent à base d’iode. Des évolutions ont également pu être obtenues en limitant la dose délivrée par l’amélioration des détecteurs et l’introduction des reconstructions itératives. Par exemple, les niveaux de dose diffèrent selon le type de scanner : scanner thoracique 7 mSv ; scanner low-dose 1,7 mSV et scanner ultra-low-dose 0,2 mSv ; pour rappel l’irradiation moyenne en France est proche de 3 mSv. L’irradiation chute ainsi depuis quelques années et si le scanner est contre-indiqué chez la femme enceinte, il peut être réalisé si nécessaire, notamment en cas d’exploration hors pelvis.
Les produits de contraste
Les produits de contraste iodés ont évolué avec aujourd’hui la possibilité d’utiliser des produits à basse osmolalité voire iso-osmolaire (injection possible en programmé jusqu’à 30 ml/min de clairance voire moins si besoin). Les volumes sont limités entre 30 et 90 ml par acquisition selon leur rapidité. Enfin, les malades n’ont plus besoin d’être à jeun avant un examen. Les biguanides ne sont arrêtés qu’après l’injection d’iode pendant 48 h.
Les avantages de l’exploration scanographique
Ce sont la rapidité d’acquisition des données, la rapidité de reconstruction des images, la visualisation des calcifications et la facilité de compréhension des images pour le demandeur (figure 1). Des techniques de soustractions des calcifications ou de traitement d’images (reconstructions avec réduction des artefacts métalliques) éliminent une partie des artefacts calciques ou métalliques. Enfin, une imagerie spectrale permet dans certains cas une analyse fonctionnelle et structurelle (perfusion pulmonaire, par exemple). Cette dernière application nécessite un scanner particulier avec des logiciels d’analyse dédiés.
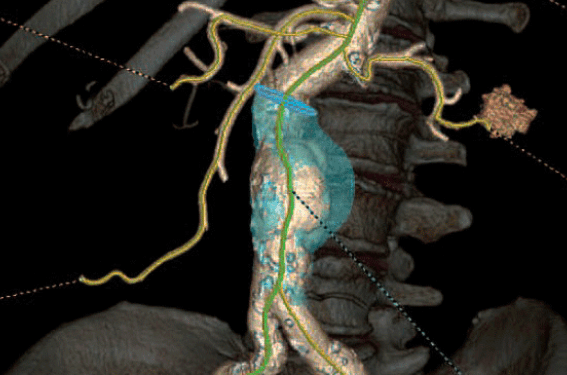
Figure 1. Angioscanner de l’aorte abdominale et de ses branches (Revo CT, courtoisie de GE). A : Vue en Maximum Intensity Projection (MIP). B : vue en Volume Rendering Technique (VRT). C : À partir de l’acquisition volumique, des coupes reformatées (MPR) peuvent être obtenues sur l’artère rénale droite (sténose 50 %, C), l’artère rénale gauche (stent perméable, (D), sur l’axe iliaque gauche sans lésion (E). Une évaluation de l’anévrisme aortique peut être faite aussi bien en volume. F : Quantification partie non circulante ou en multiplanaire, G : quantification des diamètres circulants et totaux.
Imagerie par résonance magnétique (IRM)
L’analyse des vaisseaux par des techniques d’IRM est appelée angiographie par résonance magnétique (ARM). Il existe plusieurs techniques en ARM (figure 2) qui permettent de visualiser les artères et les veines ainsi que de quantifier les vitesses et débit. Cette analyse morphologique et fonctionnelle des vaisseaux profonds ou superficiels permet d’obtenir un diagnostic anatomique mais aussi fonctionnel. Les séquences les plus utilisées sont :
Figure 2. Angiographie par résonance magnétique des artères rénales (MRI 3T, courtoisie de GE). A et B : deux techniques différentes d’acquisition sans galodolinuim ou avec (C) gadolinium. Le gadolinium offre une cartographie plus large vasculaire et plus distale, mais les acquisitions sans gadolinium bien que très ciblées sont très sensibles en présence d’une lésion sténosante ; une ARM normale élimine la suspicion de sténose. D : Angiographie par résonance magnétique des membres inférieurs sans gadolinium avec plusieurs paliers permettant d’éliminer une atteinte vasculaire.
Le temps de vol. Cette technique peut être réalisée en 2D ou 3D. Elle repose sur le principe de l’absence de signal dans les vaisseaux suite à une stimulation des spins des protons des noyaux d’hydrogène si ceux-ci sont sortis du plan de coupe étudié. Il n’y a pas d’injection de produit. La technique peut étudier des artères et des veines. Elle est réalisée principalement pour les vaisseaux intracrâniens ou les veines abdominales profondes.
Le contraste de phase. Comme avec la première séquence, il n’y a pas besoin d’injecter de produit. Les informations obtenues sont soit visualisées sous forme d’image (image en magnitude), soit sous forme de vitesse car celle-ci est proportionnelle à la vitesse de déphasage des spins (elle-même dépendante de la vitesse de déplacement des hématies). Son utilisation est en pratique utile pour l’analyse de gros vaisseaux quand le débit doit être déterminé (exemple coarctation de l’aorte).
L’angiographie par résonance magnétique sans gadolinium utilisant la différence entre systole et diastole (gating nécessaire ou pulsation au doigt), technique en apnée ou avec gating respiratoire. Cette technique est très sensible aux variations de flux et permet de détecter des lésions sténosantes. Sa valeur prédictive négative en cas d’examen normal est supérieure à 90 %. C’est une technique rapide, sans gadolinium qui peut être proposée en cas de suspicion de sténose sur un site spécifique comme les artères rénales, plus rarement pour une couverture plus étendue comme les artères des membres inférieurs (acquisition plus longue).
La technique d’acquisition d’un volume 3D avec injection d’un produit de contraste (CE-MR ou Contrast-Enhanced MRA ) permet de réduire le T1 du sang et d’entraîner un hypersignal dans les vaisseaux. Le produit est un métal lourd, dénommé gadolinium, injecté entre 1 à 2 ml/s pour un volume assez faible de 0,2 ml/kg. La dose cumulée maximale injectable durant un examen est de 3 fois cette dose. L’intérêt de cette technique est l’analyse rapide (10 à 20 secondes) d’un volume de 50 x 50 cm sur 20 cm d’épaisseur. Plusieurs niveaux anatomiques peuvent être enchaînés (MobiTrak ou Moving-Bed InfusionTRAcKing), afin d’analyser avec une seule injection de produit de contraste les membres inférieurs ou le corps entier.
Les autres techniques parfois utilisées
– le Balanced-FFE ou BFFE : technique de pseudo-angiographie, permettant d’obtenir un bon contraste entre le sang et les tissus environnants, sans injection de contraste (qualité moindre que le CE-MR) ;
– les séquences d’analyse de la paroi (pondération T1 ou T2 soit spin écho, soit écho de gradient) ;
– les séquences back-blood qui permettent d’obtenir les vaisseaux en hyposignal franc. Elles permettent de différencier le sang des parois, et ainsi, de définir précisément l’aspect des parois vasculaires ; elles annulent le signal lié aux turbulences de flux.
Les contre-indications absolues à l’IRM
Ce sont la présence d’un corps métallique ferromagnétique qui pourrait chauffer, se déplacer ou se détériorer. Les corps étrangers intra-oculaires sont une contre-indication formelle (risque de cécité). Les pace-makers, stimulateurs neurosensoriels, pompes à injection comportant une partie mécanique et électronique étaient habituellement contre-indiqués, mais les constructeurs proposent aujourd’hui des matériels dits « compatibles ».
Un encadrement strict est encore nécessaire afin de programmer le dispositif pour l’IRM et de le reprogrammer ensuite ainsi que de vérifier son bon fonctionnement. L’indication doit être hautement justifiée et l’examen non remplaçable par un autre. Les valves cardiaques récentes (depuis 2000) ne sont plus contre-indiquées en IRM, surtout pour les 1,5 tesla. Comme la durée de vie des valves est en général inférieure à 10 ans, on peut considérer que les valves actuelles ne sont plus des contre-indications. Il en est de même pour les stents coronaires ou périphériques : il n’est plus nécessaire d'attendre 6 semaines après leur implantation pour réaliser une IRM. En cas de doute, un appel en radiologie pour confirmer la conduite à tenir est recommandé. À noter que les corps étrangers métalliques, à proximité du centre d’intérêt (coils, plaques, etc.) génèrent des artefacts, notamment les endoprothèses vasculaires (souvent vides de signal ou avec aspect de sténose aux extrémités). Les malades agités, non coopérants, claustrophobes ne sont pas faciles à examiner par l’IRM qui reste un examen plus long que le scanner et avec un tunnel plus étroit pour garantir l’homogénéité du signal. Une bonne information au préalable des malades sur les conditions de réalisation est nécessaire : durée de l’examen 30 minutes mais bruyant à type de marteau piqueur (un casque peut être fourni), le tunnel est étroit mais ventilé, une injection de produit peut être nécessaire mais avec peu de risque d’allergie, l’examen n’est pas irradiant.
Les avantages de l’ARM
Ce sont la possibilité d’obtenir une couverture large ou ciblée avec une bonne résolution spatiale 3D (antenne de surface), une caractérisation tissulaire associée avec analyse de l’organe ou de la paroi, l’absence de visualisation des calcifications donc pas d’artefact, un très bon signal sur bruit avec le gadolinium, la possibilité d’obtenir une imagerie morphologique, une imagerie de flux et une imagerie de perfusion.
Points clés
Ne pas confondre évolution technique et applications médicales.
Attirance de l’image mais à interpréter avec la clinique.
Toute image peut être un artefact car liée à la machine, à l’opérateur, à la technique d’acquisition et de reconstruction, au patient, à la pathologie.
Bien comprendre les limites de l’image pour bien faire ses demandes.
La pathologie reste la même, nos questions aussi ; ce sont nos possibilités d’études qui sont différentes. Chaque technique offre une imagerie différente d’une même pathologie.
Les substitutions médicales sont difficiles et lentes alors que l’évolution technologique est rapide.
Conclusion
Toute imagerie, même nouvelle, est dépendante de l’indication (ciblée ou de dépistage), de l’opérateur (de sa compréhension de la demande par exemple), de l’appareil (différence entre les scanners, les IRM, les possibilités de traitement de l’image), du patient (échogénicité, arythmie ou incapacité de maintenir une apnée pour le scanner et l’IRM cardiaque). Aucun examen n’a une sensibilité et une spécificité de 100 %, valeurs qui sont dépendantes des facteurs cités plus haut et que le médecin radiologiste pourrait fournir.
En pathologie vasculaire, l’artériographie reste l’examen de référence, mais ses indications de première intention deviennent rares (bilan de péri-artérite noueuse, artérite membre supérieur, etc.). Elle reste d’actualité en cas de doute entre deux examens et surtout permet la réalisation des interventions endovasculaires dont les indications sont de plus en plus nombreuses par rapport à la chirurgie plus traditionnelle.
L’échographie Doppler s’est imposée comme premier examen de dépistage du fait de son innocuité, de sa facilité de réalisation et de son coût modeste. Face à une sensibilité et une spécificité parfois limite, il est recommandé de réaliser deux examens (échographie Doppler et un examen d’imagerie en coupe) dans le bilan des pathologies vasculaires qui doivent être concordants avant de poser la question d’une revascularisation. L’imagerie en coupe permet d’offrir une confirmation des lésions, de préparer le geste de revascularisation en offrant une cartographie lésionnelle, d’avoir un élément de comparaison ultérieur.
Dans les indications d’extension de la maladie athéromateuse aux autres axes artériels, l’échographie Doppler reste encore de première indication. Cependant l’ARM ou l’angioscanographie du corps entier pourrait dans l’avenir être une bonne approche si les équipements étaient plus disponibles.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :