Vasculaire
Publié le 15 oct 2018Lecture 10 min
Dissection coronaire spontanée : un syndrome coronarien aigu chez la femme jeune
Basile VERDIER, Guillaume SCHURTZ, Sina POROUCHANI, Gilles LEMESLE, USIC et Centre Hémodynamique, Institut Cœur Poumon, CHRU de Lille ; Faculté de médecine de l'université de Lille ; Institut Pasteur de Lille, Inserm UMR 1011, Lille ; FACT*
La dissection coronaire spontanée (SCAD) est reconnue comme une cause de plus en plus fréquente de syndrome coronarien aigu (SCA), en particulier chez les femmes jeunes. Récemment nous avons constaté une augmentation de la fréquence du diagnostic de SCAD, vraisemblablement en raison de l’avènement de la troponine ultrasensible, de l'utilisation accrue de l'angiographie coronaire chez les patients présentant une suspicion de SCA (y compris chez les patients à faible risque cardiovasculaire) et surtout du développement de l’imagerie endocoronaire, à savoir, l’échographie endocoronaire (IVUS) et la tomographie en cohérence optique (OCT)(1,2). Ainsi, sur les quelque 1 500 cas de SCAD signalées à ce jour dans la littérature, environ la moitié a été publiée au cours de ces 5 dernières années. Nous proposons dans cet article une revue de l’état des connaissances.
Définition
Le terme de SCAD est défini par la survenue d’une séparation spontanée (non traumatique et non iatrogène) des différentes couches de la paroi artérielle coronaire. Il est habituellement réservé à une atteinte non athéroscléreuse de la paroi artérielle.
Épidémiologie et prévalence
Pendant longtemps (et probablement encore aujourd’hui...), le diagnostic de SCAD a été sous-estimé en raison d’une entité méconnue et d’un diagnostic souvent difficile. Les rapports initiaux rapportaient une prévalence de l’ordre 0,2 % à 1,1 %, des chiffres loin de la prévalence réelle(3). Dans les cas de mort subite, la SCAD a été rapportée dans 0,5 % des cas dans une série d’autopsies en 2010(4). Toutefois, dans une récente série japonaise de 326 patients atteints de SCA et qui ont eu une imagerie OCT systématique, la SCAD a été diagnostiquée dans 4 % des cas(5). Il est probable qu’une estimation plus précise de la prévalence soit donc de l’ordre de 1,7 % à 4 % sur la base des séries modernes(1,6).
L’incidence de la SCAD chez les femmes jeunes a davantage été explorée. Cette pathologie touche en effet typiquement la femme entre 45 et 55 ans selon les données de la littérature.
Dans la série de Vanzetto et coll. portant sur des femmes de moins de 50 ans ayant présenté un SCA, la prévalence de la SCAD était de 8,7 % (10,8 % chez les patients avec un infarctus du myocarde avec sus-décalage du segment ST)(3). Les séries contemporaines ont rapporté une prévalence encore plus élevée chez les jeunes femmes avec SCA (22 % à 43 %). Dans une série japonaise récente, la SCAD était la cause du SCA chez 35 % des femmes de moins de 50 ans(7). Enfin, dans une série de femmes beaucoup plus jeunes (âge moyen de 34 ans) présentant un infarctus durant la grossesse, la SCAD était la cause la plus fréquente de SCA avec 43 % des cas(8).
Physiopathologie des SCAD et facteurs prédisposants
La SCAD peut se produire dans ou entre l’une des 3 couches (intima, média, adventice) de la paroi de l’artère coronaire. Deux mécanismes potentiels pour l’initiation de la séparation des parois artérielles sont décrits (figure 1)(1,9).
• La forme sans rupture intimale avec la présence d’un hématome intramural (classiquement secondaire à une rupture des vasa-vasorum) qui va entraîner une compression de la lumière artérielle. C’est la présentation la plus fréquente, mais aussi la plus difficile à diagnostiquer (sa fréquence est probablement sous-estimée).
• La forme avec rupture intimale : présence d’un flap intimal qui sera visible en angiographie (stagnation de produit de contraste).
Figure 1. Mécanismes de SCAD. Rupture intimale initiant une déchirure, avec formation d’hématome intramural. Hémorragie spontanée dans la paroi artérielle, créant une fausse lumière remplie d'hématome intramural.
Dans les deux cas, la présence d’une véritable compression de la lumière par l’hématome peut entraîner une ischémie myocardique et un infarctus.
L’étiologie semble être multifactorielle. Il existe certainement une « fragilité de la paroi artérielle » sous-jacente qui peut être associée à un ou des facteurs précipitants (tableaux 1 et 2). Il faut distinguer les facteurs prédisposants et les facteurs précipitants. Parmi les situations prédisposantes, on recense : la dysplasie fibromusculaire (présente dans près de 2/3 des cas selon les séries publiées et qui doit donc être systématiquement recherchée, notamment pour estimer le risque de récidive), certaines maladies du tissu conjonctif (Marfan, Ehlers-Danlos, etc.), des maladies inflammatoires systémiques (lupus, Crohn, etc.). Un facteur précipitant est également présent dans environ 60 % des cas : la prise de toxiques (cocaïne), un spasme coronaire, l’exercice physique intense ou un choc émotionnel pourraient être responsables d’une augmentation du stress et/ou des contraintes pariétales. Enfin, les manœuvres de Valsalva avec augmentation importante de la pression intrathoracique sont également parfois à l’origine de la SCAD.
Le cas particulier de la grossesse doit être abordé. Historiquement, la période de la grossesse et du post-partum immédiat était décrite comme particulièrement à risque(8). Dans les premières séries publiées, jusqu’à 30 % des SCAD survenaient lors de cette période. Les raisons sont, là encore, multiples : les taux élevés de progestérone pendant la grossesse peuvent fragiliser les parois artérielles en altérant la teneur en fibres élastiques, en mucopolysaccharides et en altérant la synthèse du collagène. Les estrogènes peuvent également créer un état d’hypercoagulabilité, les changements hémodynamiques en fin de grossesse ou encore l’augmentation des pressions intra-abdominales et intrathoraciques pendant le travail peuvent également augmenter les contraintes de cisaillement artériel. De même, les changements hormonaux lors de l’allaitement peuvent expliquer en partie un sur-risque de SCAD(10,11). Toutefois, il semble aujourd’hui que ce chiffre était largement surestimé.
Dans les séries récentes, la SCAD liée directement à la grossesse représenterait < 5 % des cas.
En revanche, les femmes multipares semblent être plus à risque (y compris à distance des grossesses). D’ailleurs, l’âge moyen de survenue de la SCAD chez les femmes, de 45 à 55 ans, est plus en lien avec ce type de terrain de femmes multipares qu’avec la période même de la grossesse. Pour terminer, il est important de noter que les facteurs prédisposants sont logiquement un peu différents chez les hommes, avec notamment une fréquence moindre de la dysplasie fibromusculaire (mais qui reste tout de même présente dans près de la moitié des cas)(12). Par ailleurs, dans le registre de Fahmy et coll., le facteur précipitant retrouvé prioritairement chez l’homme était l’exercice isométrique suivi du port d’une charge lourde alors qu’il s’agissait prioritairement d’un stress émotionnel chez la femme. Enfin, la présence, associée ou causale, de l’athérosclérose, est beaucoup plus fréquente chez l’homme et il est souvent difficile de faire la part des choses.
Présentation clinique
Les SCAD se présentent quasi systématiquement comme des SCA avec élévation de la troponine.
En dehors du terrain, qui lui est atypique (femme jeune, patient à bas risque cardiovasculaire), la présentation est celle d’un SCA classique.
La proportion de STEMI varie de manière importante selon les séries, allant de 24 % à 87 %. Comme n’importe quel SCA, certaines dissections peuvent se compliquer d’arythmies ventriculaires (3 % à 10 %), de choc cardiogénique (< 3 %) ou de mort subite cardiaque (< 1 %)(4). Les complications sont néanmoins habituellement plus rares que lors d’un SCA classique.
Diagnostic angiographique
La coronarographie est l’examen de « première ligne » en cas de suspicion de SCA.
Dans les SCAD, particulièrement sans rupture intimale, l’opérateur est confronté aux limites de l’angiographie puisque celle-ci n’est qu’un « luminogramme », ne permettant pas d’apprécier la paroi artérielle.
L’aspect pathognomonique de flap(s) radiotransparent(s) séparant les lumières, parfois associé à une stagnation de produit de contraste en fausse lumière, ne pose pas de réelles difficultés. La coronarographie a cependant des limites, notamment en cas d’hématome sans rupture intimale. Il est par ailleurs important de noter qu’au moment de la coronarographie, le degré de sténose engendrée par la SCAD peut ne pas être significatif (< 50 %). L’utilisation de dérivés nitrés au moment de la coronarographie doit être systématique et peut aider au diagnostic.
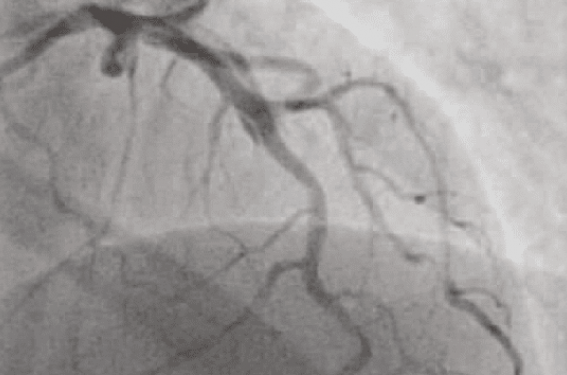
Une classification angiographique a été décrite pour mieux caractériser l’aspect des SCAD (figure 2)(13) :
• Le type 1 correspond à l’aspect pathognomonique (avec rupture intimale) avec aspect de plusieurs lumières artérielles prenant le contraste, flap intimal et la stagnation du produit de contraste dans le faux chenal (figure 2A).
• Le type 2 (absence de rupture intimale) correspond à une sténose diffuse d’importance et de longueur variable (typiquement > 20 mm), avec des changements abrupts du calibre artériel, passant du diamètre normal à un rétrécissement lisse et diffus. Ce rétrécissement diffus peut être bordé par des segments artériels normaux proximaux et distaux de l’hématome, ou s’étendre jusqu’à l’extrémité apicale de l’artère (figure 2B). Il est le plus classiquement bordé par la naissance de branches filles ; en effet, les zones de bifurcation, plus solides, empêchent l’extension de l’hématome ou de la dissection en amont ou en aval.
• Le type 3 (absence de rupture intimale) décrit une sténose focale (typiquement < 20 mm) mimant l’athérosclérose et qui nécessite une imagerie intracoronaire pour confirmer le diagnostic (figure 2C).
Attention, dans le type 1, la simple réalisation de la coronarographie avec l’injection antérograde de produit de contraste peut aggraver la dissection en facilitant l’extension de celle-ci. Le cathétérisme des ostia coronaires et les injections devront donc être réalisés avec prudence. Dans une publication récente, l’aspect angiographique de SCAD le plus fréquent était logiquement le type 1 dans 67,5 % des cas (le plus facile à diagnostiquer), suivi par le type 2 dans 29,1 % des cas et le type 3 dans 3,4 % des cas(10,13). Il est néanmoins très important de noter que le type 3 est de loin le type de SCAD le plus difficile à diagnostiquer et sa fréquence est, de ce fait, probablement largement sous-estimée. Toutes les artères coronaires peuvent être affectées par une SCAD, mais l’atteinte coronaire est volontiers une atteinte distale(10,13).
Figure 2. Classification angiographique des SCAD. A. Type 1 : prise de contraste de la paroi, lumières multiples, stagnation de produit de contraste dans le faux chenal. B. Type 2 : sténose diffuse (> 20 mm), changement abrupt de calibre artériel entre les branches accessoires. C. Type 3 : sténose focale ou tubulaire (< 20 mm) mimant l’athérosclérose, nécessitant une imagerie endocoronaire.
Intérêt diagnostique de l’imagerie endocoronaire
L’imagerie endocoronaire n’a que très peu d’intérêt, et peut être dangereuse par risque d’aggravation de la SCAD, notamment en cas de SCAD de type 1 dont le diagnostic est en général facilement posé lors d’une coronarographie bien réalisée.
Ces méthodes invasives nécessitent en effet une anticoagulation (pouvant aggraver l’hématome) et un nombre plus important de guides intracoronaires. Elles rendent non négligeable le risque d’extension de la lésion et l’occlusion iatrogène du vaisseau est redoutée par les angioplasticiens en cas de type 1.
L’imagerie endocoronaire, notamment par OCT a, en revanche, fait la démonstration de sa valeur ajoutée dans les cas ambigus (type 2 et surtout 3), et permet de poser le diagnostic de SCAD de manière certaine.
De par son excellente résolution (10-20 μm), l’OCT peut visualiser une porte d’entrée intimale, mesurer l’extension longitudinale de l’hématome et les surfaces et diamètres des vraies et fausses lumières(6,14). Toutefois, l’OCT et l’IVUS sont des techniques coûteuses, non remboursées, et tous les centres n’en sont pas équipés en France.
Stratégie thérapeutique
• Il n’existe que peu de données scientifiques de grande qualité sur la prise en charge des SCAD. Les recommandations actuelles sont basées sur des consensus d’experts issus de séries d’observation.
Il existe depuis 2016 un consensus sur l’intérêt d’une prise en charge initiale la plus conservatrice possible chez les patients stables (traitement médical seul).
Cette stratégie conservatrice est basée sur l’observation d’une cicatrisation pariétale, spontanée dans la grande majorité des cas, sur des contrôles angiographiques tardifs(2). Toutefois, la stratégie médicamenteuse optimale reste à ce jour très discutée en l’absence d’étude randomisée.
L’instauration d’un traitement bêtabloquant semble faire consensus.
Ce traitement semble limiter l’aggravation initiale et le risque de récidive à distance. Il permet de réduire le « shear-stress » et de diminuer le risque de troubles du rythme ventriculaire. Ce traitement est essentiellement prescrit par extension des données observées dans la dissection aortique. Le bénéfice des traitements anticoagulants et antiagrégants plaquettaires est controversé. Il est aujourd’hui suggéré d’être le moins agressif possible sur les traitements antithrombotiques en raison du risque potentiel d’aggravation des lésions coronaires.
Il est habituellement prescrit un traitement par aspirine en monothérapie.
Le bénéfice bien établi de l’aspirine en phase aiguë de tous les SCA et en prévention secondaire, associé à son faible profil de risque hémorragique, incitent à poursuivre ce médicament au long cours. La double antiagrégation plaquettaire n’est pas recommandée en l’absence de revascularisation. Il n’existe pas non plus de consensus sur l’intérêt des statines ou des inhibiteurs de l’enzyme de conversion/antagonistes du récepteur de l’angiotensine II (IEC/ARA2) dans les SCAD. Ces traitements sont parfois utilisés par extension des données obtenues dans le SCA tout-venant, notamment en raison de leur absence d’effet délétère propre sur la SCAD. L’absence d’athérome, quasi systématique dans les SCAD, n’incite toutefois pas à une généralisation de leur usage dans cette indication.
• La revascularisation s’impose néanmoins parfois : en cas d’occlusion coronaire complète, d’ischémie myocardique récurrente, d’instabilité hémodynamique, de douleur persistante, de survenue d’arythmies ventriculaires ou d’atteinte du tronc commun. L’angioplastie est alors à envisager en première intention, même si elle est techniquement délicate (taux de succès faible ≈ 50 %)(3,14,15). La chirurgie de pontage est difficile à réaliser en raison des difficultés d’anastomose sur des parois fragiles et disséquées. L’imagerie endocoronaire et notamment l’OCT a montré un apport thérapeutique dans le guidage d’une angioplastie de sauvetage en permettant de vérifier le positionnement du guide dans le bon chenal, de choisir la bonne longueur du stent afin de couvrir la totalité de la dissection, de vérifier le bon déploiement et la bonne apposition du stent, de s’assurer de la fermeture d’une éventuelle porte d’entrée, et d’évaluer l’hématome pariétal résiduel. Nous avons résumé les principaux risques et nos suggestions techniques dans les tableaux 3 et 4 en cas de revascularisation par angioplastie coronaire percutanée.
Évolution et récurrence
Le pronostic est en général plutôt bon et meilleur que celui d’un SCA classique, notamment en raison de l’atteinte coronaire distale (IDM de petite taille) et de la cicatrisation spontanée des lésions. La mortalité hospitalière est assez faible, < 5 %(1,2). Les récurrences ischémiques ou les revascularisations urgentes chez les patients avec stratégie initiale conservatrice sont rares < 10 %(3,7,15,16). Le pronostic à long terme des patients survivant à la phase aiguë est bon, même s’il faut garder en mémoire le risque non négligeable de récidive qui justifie un suivi cardiovasculaire attentif (≈ 15 % à 2 ans). Parmi les femmes en âge de procréer, la grossesse est déconseillée en raison du risque de récidive.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :