Publié le 21 mai 2024Lecture 8 min
L’embolie pulmonaire en pratique
Céline GOYARD, service de pneumologie, hôpital Foch, Suresnes
La maladie thrombo-embolique veineuse (MTEV) regroupe 2 entités cliniques : les thromboses veineuses profondes (TVP) et l’embolie pulmonaire (EP). Il s’agit d’une maladie fréquente avec une incidence annuelle en France estimée à 2 pour 1 000 habitants. Elle correspond à la survenue d’une occlusion partielle ou totale d’une veine des membres inférieurs, du tronc de l’artère pulmonaire ou d’une de ses branches par un thrombus fibrino-cruorique. Il s’agit d’une maladie potentiellement grave avec une mortalité à 3 mois de 5 à 10 %.
La formation du caillot est favorisée par la stase veineuse, les lésions de l’endothélium vasculaire et un état d’hypercoagulabilité (Triade de Virchow). La majorité des thrombi se forment dans les veines des jambes ou du pelvis puis migrent au niveau des artères pulmonaires. La gravité de la maladie est principalement liée aux conséquences hémodynamiques. L’obstruction aiguë d’une partie du lit vasculaire pulmonaire va entraîner une augmentation de la pression artérielle pulmonaire et de la post-charge du ventricule droit qui se dilate pour aboutir à un état de choc.
La MTEV résulte de la combinaison de facteurs individuels et de circonstances favorisantes. Ces facteurs de risque ont été séparés en différents groupes par l’ISTH permettant de distinguer des événements thromboemboliques veineux provoqués par un facteur de risque transitoire ou persistant de ceux qui sont non provoqués (ou idiopathiques). Seul un facteur de risque majeur peut être considéré comme expliquant à lui seul la survenue de l’événement (tableau 1).
DES SYMPTÔMES PEU SPÉCIFIQUES
Le plus souvent le diagnostic est évoqué sur la base d’une dyspnée (79 %), d’une douleur thoracique (47 %) éventuellement associée à des hémoptysies de faible abondance accompagnées d’une douleur unilatérale d’un membre inférieur moins d’une fois sur deux. L’examen clinique est pauvre, ne permet jamais le diagnostic, mais identifie les signes de gravité (insuffisance cardiaque droite et état de choc).
Le diagnostic repose sur 3 grandes étapes :
1- Suspecter l’embolie pulmonaire en se basant sur la clinique et l’identification de facteurs de risque (tableau 1). La réalisation d’examens complémentaires de première intention permet d’éliminer les diagnostics différentiels (ECG et radiographie thoracique).
2 - Établir une probabilité clinique d’embolie pulmonaire. Cette étape est indispensable, car elle conditionne la probabilité post-test d’embolie pulmonaire, quel que soit l’examen choisi. La probabilité clinique peut être établie de manière empirique ou en utilisant l’un des scores validés de WELLS ou GENEVE (tableau 2).
3 - Prescrire un examen paraclinique pour confirmer ou éliminer le diagnostic
En cas de probabilité clinique non forte, le dosage des D-dimères (produit de la dégradation de la fibrine qui compose le caillot) est l’examen de première intention à réaliser. En raison d’une excellente valeur de prédiction négative (VPN), un taux de dimère < 500 µg/l chez les moins de 50 ans ou < (10 x âge) chez les patients de 50 ans et plus, permet d’exclure le diagnostic. Il est donc utile de les doser, même en cas de facteur confondant (cancer, infection, grossesse…), car la spécificité du test est conservée et lorsqu’ils sont négatifs, ils permettent d’exclure le diagnostic et d’éviter la réalisation d’examens plus invasifs.
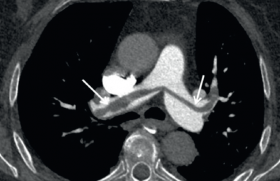
Lorsque les D-dimères sont positifs ou en cas de probabilité clinique forte l’angioscanner thoracique est l’examen de choix pour rechercher une embolie pulmonaire (facilité d’accès et d’interprétation). En cas de contre-indication à la réalisation de ce dernier (allergie au produit de contraste iodé, insuffisance rénale sévère…), une scintigraphie pulmonaire de ventilation perfusion et/ou une échographie veineuse de compression des membres inférieurs peuvent être proposées (tableau 3). La conduite à tenir est résumée dans la figure 1.
Figure 1. Algorithme diagnostique de l’embolie pulmonaire.
TRAITEMENT À LA PHASE AIGUË (figure 2)
Figure 2. Orientation et prise en charge du patient en fonction de l’évaluation de la sévérité et du pronostic de l’épisode, d’après(3,4).
Le traitement consiste en une anticoagulation à dose curative permettant de stopper la progression des thrombi, de favoriser la fibrinolyse intrinsèque et de prévenir les récidives thromboemboliques.
Un lever précoce, une heure après avoir reçu le traitement, est autorisé chez les patients cliniquement stables. Le port de bas de contention est indiqué en cas de TVP associée pendant 6 mois minimum afin de prévenir le syndrome post-thrombotique.
Les différents anticoagulants sont listés dans le tableau 4. En cas de contre-indication à une anticoagulation efficace ou de récidive thrombo-embolique sous traitement bien conduit, la pose d’un filtre cave temporaire est recommandée.
L’évaluation de la sévérité initiale et donc du pronostic de l’épisode va guider la prise en charge et l’orientation du patient. L’existence d’un état de choc, le calcul de l’index de sévérité de l’EP (score sPESI, tableau 5) et les critères paracliniques de dysfonction ventriculaire droite évalués sur l’échocardiographie transthoracique (ETT), l’angioscanner et l’élévation des biomarqueurs cardiaques (Troponine et BNP ou NT-proBNP) doivent être recherchés de manière systématique.
Les patients avec un score sPESI à 0 et sans dysfonction cardiaque droite sont à risque faible de mortalité (1 % à 30 jours) et peuvent maintenant être pris en charge en ambulatoire. L’algorithme décisionnel est résumé dans l’encadré 1.
L’EMBOLIE PULMONAIRE GRAVE
La forme grave est définie par la présence d’un état de choc clinique n’autorisant pas la mobilisation du patient. Il s’agit d’un mode de présentation rare (environ 5 % des EP), mais grevée d’une mortalité élevée estimée entre 25 et 50 %. Le diagnostic doit être porté rapidement en réalisant une échographie cardiaque au lit du malade à la recherche de thrombi dans les cavités cardiaques droites ou dans le tronc de l’artère pulmonaire, ou des signes de cœur pulmonaire aigu (dilatation du ventricule droit, présence d’un septum paradoxal). L’angioscanner thoracique ne sera réalisé que dans un deuxième temps après stabilisation hémodynamique.
Le traitement doit être débuté en urgence par administration d’héparine non fractionnée en IV à la seringue électrique qui nécessite une surveillance de l ’activité anti-Xa et un traitement fibrinolytique permettant une désobstruction vasculaire en l’absence de contre-indication formelle (hémorragie cérébrale). En cas d’échec de la thrombolyse ou de contre-indication, l’embolectomie chirurgicale ou percutanée peut être proposée dans les centres experts.
LE SUIVI EST ESSENTIEL
Tout patient présentant une embolie pulmonaire doit être suivi de manière rapprochée dans le cadre d’une filière de soins organisée, d’autant plus chez les patients pris en charge en ambulatoire (figure 3).
Figure 3. Suivi après une embolie pulmonaire d’après(4).
Une consultation rapide dans les 72 heures est recommandée(4) afin de confirmer le diagnostic et le choix thérapeutique, mais aussi de prendre le temps de débriefer avec le patient de l’épisode et de s’assurer de l’adhésion au traitement.
Dans le premier mois, il convient de poursuivre l’éducation thérapeutique et de s’assurer de la bonne tolérance du traitement. En absence de facteur de risque majeur identifié, les examens complémentaires du bilan étiologique serontréalisés à la recherche d’une néoplasie occulte ou d’une thrombophilie si indiqué (encadré 1).
La réalisation systématique d’un scannerthoraco-abdomino-pelvien ou d’un TEP scanner n’est pas recommandée, car il s’agit d’examens onéreux pour lesquels les études n’ont pas montré de bénéfice en termes de pronostic. Le bilan de thrombophilie doit être réservé aux situations particulières avec évènement non provoqué avant 50 ans et histoire familiale au premier degré, évènements récidivants avant 50 ans ou en cas de localisation atypique (membre supérieur, splénique, cérébrale).
En effet, dans le cas des thrombophilies mineures, le risque de récidive conféré par la thrombophilie est très inférieur à celui conféré par le simple fait d’avoir fait un épisode non provoqué. La documentation de la thrombophilie n’a donc aucune conséquence sur la décision thérapeutique.
Une consultation dans les 3 à 6 mois est indispensable pour décider de la durée du traitement anticoagulant qui dépend uniquement du risque de récidive de l’épisode. Après la phase aiguë, l’objectif est la prévention secondaire des récidives. En cas de risque de récidive faible, un traitement court de 3 à 6 mois est suffisant. C’est le cas lorsqu’un épisode est provoqué par un facteur de risque majeur transitoire ou s’il s’agit d’un épisode non provoqué survenant chez une femme de < 50 ans ou présentant un score HERDOO 2 ≤ 1 (tableau 6).
En cas de facteur de risque majeur persistant (cancer ou thrombophilie majeure) ou d’EP non provoquées récidivantes, l’anticoagulation doit être poursuivie pour une durée non limitée, car le risque de récidive est élevé. Un arrêt des anticoagulants est possible, 6 mois après la guérison d’un cancer, si celui-ci n’est pas à haut risque de récidive. Après un premier épisode non provoqué, le risque de récidive à l’arrêt du traitement est estimé entre 7 et 10 %/an et est identique quelle que soit la durée initiale de traitement, pourvu qu’elle ait été d’au minimum 6 mois. Dans cette situation, la durée est incertaine (minimum 6 mois ou non limitée) et doit donc faire l’objet d’une discussion avec le patient après une information éclairée.
Elle doit tenir compte de la gravité de l’épisode initial et de l’estimation du risque hémorragique.
Chez les patients pour qui un traitement anticoagulant est maintenu au long cours, une consultation annuelle permet de réévaluer le rapport bénéfice-risque de la poursuite du traitement en mettant en balance le risque de saignement.
DÉPISTAGE DES SÉQUELLES ET DE L’HYPERTENSION PULMONAIRE THROMBO-EMBOLIQUE CHRONIQUE (HTP-TEC)(6)
Après une embolie pulmonaire, les thrombi disparaissent pour la majorité en 10 à 21 jours, mais chez certains patients les thrombi persistent et s’organisent en un matériel fibreux adhérent aux parois vasculaires. De 30 à 50 % des patients gardent une obstruction vasculaire résiduelle visible à la scintigraphie pulmonaire à 1 an de l’épisode et une petite partie d’entre eux vont développer une hypertension pulmonaire. La fréquence est actuellement estimée entre 1 et 2 % après une EP.
Le diagnostic peut être évoqué dès la phase aiguë chez les patients qui présentent à l’ETT des pressions artérielles pulmonaires systoliques (PAPs) > 50/60 mmHg ou sur l’angioscanner les images évoquant des séquelles thromboemboliques chroniques associées aux thrombi aigus.
Au cours du suivi, l’HTP-TEC doit être systématiquement recherchée chez les patients qui gardent une dyspnée à plus de 3 mois de traitement anticoagulant bien conduit. Le dépistage repose sur la réalisation :
– d’une ETT pour évaluer la probabilité échographique d’HTP sur la base de la mesure de la vitesse du flux de régurgitation tricuspide et la présence de signes indirects additionnels ;
– d’une scintigraphie pulmonaire V/Q planaire pour rechercher des defects de perfusions missmatchés.
Le diagnostic sera confirmé par réalisation d’un cathétérisme cardiaque droit dans un centre expert.
Le traitement repose sur une anticoagulation à dose curative.
L’évaluation de la sévérité de l’épisode guide l’orientation du malade.
Une prise en charge ambulatoire est maintenant possible lorsque le risque de mortalité estimé est faible sous réserve d’un parcours ambulatoire défini.
Le suivi après l’épisode aigu est indispensable pour réaliser le bilan étiologique, décider de la durée du traitement et dépister la survenue d’une HTP-TEC.
POINTS CLÉS
L’embolie pulmonaire est une maladie fréquente et potentiellement grave.
Le diagnostic est difficile et repose sur 3 grandes étapes :
– l’évocation du diagnostic ;
– l’établissement d’une probabilité clinique d’EP ;
– la réalisation d’examen paraclinique (D-dimères, angioscanner ou scintigraphie pulmonaire) pour confirmer le diagnostic.
L’auteur déclare ne pas avoir de conflit d’intérêts en rapport avec cet article.
Publié dans OPA Pratique
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :