Chirurgie
Publié le 28 oct 2024Lecture 7 min
La transplantation cardiaque : mise au point
Céline GOÉMINNE(1), Delphine DEBLAUWE(2), Natacha ROUSSE(3)*, Lille

La transplantation cardiaque est le traitement de référence de l’insuffisance cardiaque avancée, pour des patients sélectionnés. Les registres nationaux et internationaux estiment la survie à 1 an autour 85 à 90 %(1,2). La médiane de survie, conditionnée à la survie à 1 an, est quant à elle estimée à 12,5 ans dans les registres récents(2). Ces résultats, à court terme, sont obtenus après sélection rigoureuse des candidats à la transplantation et sont à nuancer par un accès malheureusement limité à la greffe, en lien avec une pénurie de greffons, qui perdure au fil des ans, et qui est estimée à 1 greffon pour 2,2 receveurs.
Sélection des candidats à la transplantation cardiaque
L’éligibilité à la transplantation cardiaque est à discuter chez tout patient présentant une insuffisance cardiaque avancée, qu’elle se présente sur un mode chronique (INTERMACS 4 ou 5) ou aigu (INTERMACS 1 à 3) (tableau 1). Le tableau 2, adapté des recommandations de l’ESC(3), résume les principales contre-indications à la transplantation cardiaque. La plupart de celles-ci nécessitent d’être évaluées au cas par cas, par une équipe multidisciplinaire, médico-chirurgicale, incluant également des spécialistes d’autres organes et des paramédicaux. L’inscription sur liste d’attente de transplantation cardiaque est réalisée après information du patient, si possible en présence de son entourage, en explicitant clairement la notion de rapport bénéfice risque et recueil de son consentement.
Score national d’attribution des greffons
Depuis le 1er janvier 2018, l’Agence de Biomédecine a mis en place un nouveau système d’allocation des greffons cardiaques(4). Ce score national a pour buts de répartir sur le territoire les greffons, ressource limitée, de manière :
– équitable : en tenant compte de la gravité des patients en attente ;
– transparente : fondée sur des critères objectifs, un greffon est attribué à un receveur donné.
La gravité du receveur est établie par la saisie de données à l’inscription, et régulièrement réévaluée durant la période d’attente (cela détermine l’ICAR Index de Risque Cardiaque et le Score Cardiaque Composite Brut). Certaines exceptions au score peuvent générer une demande d’expertise (Composantes Expertes). L’appariement entre le donneur et le receveur (morphologie, âge, groupe sanguin) permet de calculer le Score Cardiaque Composite Pondéré. Les résultats attendus de la greffe sont intégrés dans ce dernier score et calculés à partir des données biologiques renseignées dans le calcul de l’ICAR. En cas de survie prédite < 50 %, le receveur n’est pas éligible à un greffon. Le score final, qui est le Score National d’Attribution des Greffons Cardiaques intègre, enfin, la dimension géographique, c’est-à-dire, la distance entre les lieux de prélèvement et de greffe (figure 1).
Figure 1. Étapes de construction du « Score Cœur ».
Ainsi, les receveurs ayant le plus de points ont la plus forte probabilité d’être transplantés (figure 2). En 2021, la médiane de Score Brut, hors appariement donneur, est de 750, c’est-à-dire que 50 % des patients accédant à un greffon avaient un score brut > 750.
Figure 2. Score Cardiaque Composite Brut.
Morbi-mortalité et risques périopératoires
Si la première transplantation cardiaque d’un donneur humain sur un receveur humain a été réalisée en Afrique du Sud en 1967 grâce à la mise au point de la technique chirurgicale par C. Barnard et N. Shumway, ce n’est que dans les années 80, avec la découverte de la ciclosporine A, immunosuppresseur, que l’on assiste à l’essor de cette activité. La technique dite biatriale (de Shumway) a été supplantée ultérieurement par la technique bicave(5).
Comme pour toute intervention chirurgicale, le risque de l’intervention est majoré en cas d’antécédent de chirurgie cardiaque (parfois 2-3 interventions au préalable, voire plus), en raison d’adhérences lors de la dissection des tissus, adhérences qui peuvent conduire à une hémorragie difficile à juguler, et à un allongement de la durée d’ischémie du nouveau greffon si ces difficultés ont mal été anticipées (durée de non-perfusion, on parle d’ischémie froide : durée au cours de laquelle le greffon est placé dans du sérum glacé, d’ischémie chaude : durée du geste de transplantation et sutures chirurgicales, et d’ischémie totale : addition de ces deux durées).
Une fois l’intervention achevée, les principales complications graves précoces sont la dysfonction primaire de greffon, le sepsis et l’hémorragie.
La dysfonction primaire de greffon (DPG) obéit à une définition stricte et complexe(6). Pour simplifier, on parle de DPG sévère lorsque la FEVG est inférieure à 30 %, et/ou lorsqu’une assistance circulatoire de courte durée (ECLS) est nécessaire dans les 24 heures suivant la transplantation cardiaque (définition de l’Agence de Biomédecine). En 2020, en France, 40,3 % des transplantations cardiaques se sont compliquées de DPG sévère (données ABM). La DPG est une complication qui peut être mortelle et participe au taux d’échec de la transplantation cardiaque qui enregistre 23 % de décès à un an(1).
Le choix du greffon cardiaque apparaît primordial pour prévenir cette complication, tout comme la gestion du temps d’ischémie de ce dernier. En effet, les principales études indiquent que la durée prolongée d’ischémie totale du greffon (supérieure à 4 h), les paramètres hémodynamiques du donneur, le sexe (en particulier donneur de sexe féminin pour receveur de sexe masculin), l’âge du donneur (> 30 ans) soient péjoratifs (score RADIAL, 6).
Nous avons déjà parlé de la pénurie globale de greffons cardiaques, pénurie encore plus marquée depuis la crise sanitaire de la Covid. Ajoutons qu’en France, les greffons disponibles ont un âge moyen de 44 ans, âge qui tend à augmenter, avec 36 % de donneurs(1). Les variables d’ajustement sur lesquelles nous travaillons sont l’optimisation des paramètres morphologiques donneur-receveur, l’optimisation hémodynamique du donneur (remplissage vasculaire, transfusion sanguine, hormone antidiurétique, etc.) et surtout l’optimisation du temps d’ischémie, avec les techniques de perfusion ex vivo.
Suivi au long cours des greffés
Le suivi au long cours des patients greffés est, d’une part, cardiologique, à la recherche de défaillance de greffon en rapport avec un rejet. Ce rejet peut être aigu et se dépiste par la réalisation de biopsies endomyocardiques. Le risque de rejet est d’autant plus élevé que la transplantation est récente mais persiste au long cours, ce qui impose la poursuite des traitements anti-rejets à vie. Certains patients, en particulier immunisés, ont un risque de rejet accru. Le rejet chronique s’exprime préférentiellement par une atteinte vasculaire coronaire spécifique appelée « cardiac allograft vasculopathy » et justifie la surveillance régulière du réseau coronaire par coronarographies comparatives, coroscanners et/ou tests d’ischémie non invasifs en cas d’insuffisance rénale. D’autre part, l’immunosuppression expose à des complications extra-cardiologiques : infectieuses, toxiques (toxicité rénale) et carcinologiques, justifiant de coordonner des suivis spécialisés spécifiques : suivi néphrologique, rhumatologique (ostéoporose) dépistage renforcé de cancers, en particulier cutanés, etc. (tableau 3 et figure 3).
Figure 3. Incidences relatives des causes de décès post-transplantation cardiaque, d’après le registre de l’ISHLT.
Perspectives d’avenir en transplantation cardiaque
Les enjeux d’avenir sont en priorité d’augmenter le pool de greffons disponibles, ainsi que d’optimiser les résultats de la transplantation en diminuant le taux de dysfonction primaire de greffon qui, malgré les avancées technologiques, reste élevé en France avec un taux avoisinant les 40 %(1).
Depuis quelques années, des modèles de perfusion ex vivo cardiaque se sont développés, avec pour objectif de permettre un accès à des greffons plus loin en distance géographique et/ou à des greffons considérés comme marginaux(7).
La réduction considérable du temps d’ischémie permise par ces techniques, grâce à une perfusion continue du greffon durant le transport et l’explantation cardiaque du receveur, est également une piste fiable pour améliorer la qualité des greffons disponibles actuellement.
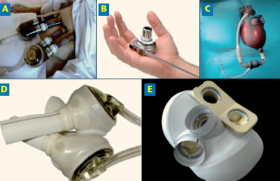
La perfusion ex vivo normothermique est utilisée depuis 2019 en France au moyen de l’Organ Care System Heart de Transmedics® (figure 4). Cette technique validée permet un transport du greffon perfusé, battant et à 34° C, et permet également une évaluation métabolique de l’organe perfusé.
D’après García Sáez et al. Ann Thorac Surg 2014 ; 98 : 2099-106.
Figure 4. Schéma simplifié du système OCS.
Un autre modèle de perfusion ex vivo continue en hypothermie (X-VIVO®) est également en cours d’évaluation clinique en France et en Europe.
Le développement de ces techniques marque une avancée considérable et ouvre la possibilité d’un accès à d’autres populations de donneurs à l’avenir pour les greffons cardiaques, tel que les donneurs décédés d’arrêt circulatoire de la catégorie III de Maastricht, dont le protocole de faisabilité en France est actuellement en cours auprès de l’Agence de Biomédecine.
L’optimisation de ces techniques et les futures innovations complémentaires pourraient permettre à l’avenir une meilleure évaluation des greffons de qualité incertaine (absence d’évaluation coronaire chez le donneur, arrêt cardiaque prolongé, âge avancé, etc.), ainsi qu’une réhabilitation de certains greffons à ce jour inéligibles pour la transplantation.
En pratique
La transplantation cardiaque reste la thérapeutique de référence dans l’insuffisance cardiaque avancée réfractaire.
Bien qu’il existe d’indéniables avancées médicamenteuses dans l’insuffisance cardiaque, il est important de souligner que « l’escalade médicamenteuse » ne doit pas retarder un projet de transplantation cardiaque, car les délais d’attente sur liste doivent être pris en considération dans le contexte de pénurie de greffon.
Par ailleurs, l’amélioration des résultats de la transplantation cardiaque doit passer par une sélection rigoureuse des candidats, la contre-indication à la greffe d’emblée des patients trop graves (en proposant l’assistance de longue durée en alternative), d’où l’importance d’adresser les patients tôt.
La sélection du greffon est primordiale afin de limiter les risques de défaillance primaire du greffon, de même que l’optimisation des délais d’ischémie.
Enfin, d’autres sources de greffons sont à l’étude afin de réduire la pénurie.
* 1 Cardiologue, Unité de transplantation et assistance cardiaque, Institut Cœur Poumon, CHU de Lille
2 Anesthésiste-réanimateur, Unité de transplantation et assistance cardiaque, Institut Cœur Poumon, CHU de Lille
3 Chirurgien cardiaque, service de chirurgie cardiaque, Institut Cœur Poumon, CHU de Lille
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :