Thérapeutique
Publié le 11 sep 2012Lecture 11 min
Transplantation cardiaque - Le rejet aigu et les traitements immunosuppresseurs en 2012
R. DORENT, Hôpital Tenon, L. LEPAGE, Hôpital Bichat-Claude-Bernard, Paris
L’amélioration des résultats de la transplantation cardiaque s’explique pour beaucoup par les progrès des traitements immunosuppresseurs. De nouvelles combinaisons plus spécifiques des cellules qui participent au rejet avec moins d’effets indésirables ouvrent la voie vers une nouvelle ère. À côté de l’amélioration de la qualité de la vie, l’allongement de l’espérance de vie des transplantés cardiaques doit dès à présent conduire à organiser un suivi partagé entre médecins transplanteurs et cardiologues. Ce suivi partagé implique une formation aux spécificités des traitements des greffés.
Depuis la première transplantation cardiaque en décembre 1967, la technique chirurgicale a peu évolué puisque le seul changement notable a été l’introduction de l’anastomose bicave. La technique de la biopsie endomyocardique mise au point pendant les années 70 reste actuellement la méthode de référence pour le diagnostic des rejets aigus. Les années 80 avec l’introduction de la ciclosporine ont été celles pendant lesquelles l’activité de greffe cardiaque a commencé véritablement à se développer. Pendant les années 90 et 2000, de nouveaux immunosuppresseurs ont été développés avec succès. Des progrès majeurs ont été faits par ailleurs dans la prévention et le traitement des infections opportunistes, ainsi que dans ceux de la maladie coronaire du greffon. La prise en charge des dysfonctions précoces du greffon a, pour sa part, grandement bénéficié du recours à l’ECMO. Aujourd’hui en France, les taux de survie à 5 ans et 10 ans après une greffe cardiaque sont respectivement de 65 % et 52 %. Cette mise au point vise à présenter l’état des connaissances sur le rejet aigu et les traitements immunosuppresseurs.
Rejet aigu
Le succès de la transplantation repose en grande partie sur la possibilité de trouver un équilibre entre le rejet aigu et les complications des traitements immunosuppresseurs.
Même si la fréquence des rejets aigus cellulaires a beaucoup diminué au cours de ces dernières années grâce à l’utilisation de combinaisons thérapeutiques de plus en plus efficaces, ils restent l’une des principales causes de décès pendant la première année après la greffe.
C’est dans ce contexte que les rejets aigus médiés par les anticorps, plus rares, mais associés aux dysfonctions du greffon et à la maladie coronaire du greffon, ont émergé. La recherche de nouveaux immunosuppresseurs avec moins d’effets indésirables et d’immunosuppresseurs ciblant spécifiquement l’activation des lymphocytes B est en plein essor.
Mécanismes du rejet aigu cellulaire : au-delà de l’interleukine 2
La réponse adaptative, qui résulte de la reconnaissance des antigènes HLA du donneur par les lymphocytes T du receveur, est le mécanisme immunologique central dans le rejet d’allogreffe. La figure 1 montre les mécanismes moléculaires qui conduisent à l’activation et à la prolifération du lymphocyte T au cours de la réponse immune. Les immunosuppresseurs sont classés en fonction de leur cible dans ce modèle à 3 signaux.
Figure 1. Mécanismes moléculaires de l’activation du lymphocyte T.
Le premier signal provient de la reconnaissance par le récepteur du lymphocyte T du complexe, molécule HLA-peptide, porté par la cellule présentatrice de l’antigène (CPA).
Le deuxième signal, dit « de costimulation », est initié par la liaison des molécules CD80, CD86 présentes à la surface des CPA au récepteur CD28 porté par les lymphocytes. Ces deux signaux provoquent l’activation de plusieurs voies de signalisation intracellulaire qui activent des facteurs de transcription lesquels favorisent l’expression de nombreux gènes dont ceux qui codent pour l’interleukine- 2 (IL-2) et la chaine du récepteur à l’IL-2. Parmi ces voies de signalisation figure celle de la calcineurine, qui, activée, déphosphoryle le facteur de transcription NF-AT (Nuclear Factor of Activated T cell) cytoplasmique qui peut alors transloquer vers le noyau.
Le troisième signal résulte de la fixation de l’IL-2 sur son récepteur (CD25) à la surface du lymphocyte T. Ce signal active la voie Pi3K/mTOR qui régule la synthèse de protéines nécessaires à la progression du cycle cellulaire avec le passage de la phase G1 à la phase S. Ce signal initie la prolifération des lymphocytes T activés.
Diagnostic du rejet aigu
Les rejets aigus cellulaires se produisent très majoritairement dans les 6 mois après la transplantation. Environ 20 à 40 % des greffés ont au moins un épisode de rejet. Les rejets sont longtemps asymptomatiques. Les symptômes d’insuffisance ventriculaire droite, la dyspnée, les palpitations et les syncopes doivent faire évoquer le diagnostic. Les rejets sont détectés en pratique par des biopsies endomyocardiques réalisées régulièrement. La fréquence des biopsies pendant la première année et surtout après varie suivant les centres. Une biopsie doit systématiquement être faite en cas de suspicion clinique de rejet. L’examen se fait avec un bioptome introduit par la veine jugulaire interne droite. Les complications sont rares (ponction artérielle, pneumothorax, Claude Bernard Horner transitoire, lésion de la tricuspide, perforation cardiaque). La classification des rejets de la Société Internationale de Transplantation Cardiaque et Pulmonaire de 1990 révisée en 2004 (tableau 1) s’est largement imposée.
L’échographie ne permet pas de se passer des biopsies, mais est un outil complémentaire indispensable dans l’évaluation des rejets.
La survenue d’une hypertrophie ventriculaire gauche, d’un trouble de la compliance, d’une augmentation des pressions de remplissage, d’une anomalie de la fonction systolique, d’un épanchement péricardique évoque un rejet. Si aujourd’hui il n’y pas de marqueur biologique ayant fait la preuve de sa valeur diagnostique, l’évaluation du profil d’expression des gènes par l’analyse des transcripts de 11 gènes dans les cellules sanguines mononuclées circulantes avec le test AlloMap, grâce à sa bonne valeur prédictive négative (rejets grade 2 R ou 3 R), permet de diminuer le nombre des biopsies réalisées chez les patients qui ont été greffés il y a plus de 6 mois.
Les rejets aigus médiés par les anticorps se produisent chez 10 % environ des patients. Ils peuvent survenir pendant la première année, mais aussi tard après la greffe. Leur diagnostic repose sur la biopsie endomyocardique suivant des critères histologiques (accumulation de macrophages intravasculaires, gonflement des cellules endothéliales) et immunohistologiques (dépôts dans les capillaires de C4d et C3d en immunofluorescence ou en immunohistochimie). Bien que n’entrant pas stricto sensu dans la définition, des critères sérologiques (présence d’anticorps anti-HLA spécifiques du donneur) et la présence d’une dysfonction du greffon sont également pris en compte pour retenir le diagnostic de rejet médié par les anticorps.
Traitements immunosuppresseurs
Les principaux médicaments immunosuppresseurs utilisés en transplantation cardiaque sont mentionnés dans le tableau 2 avec leur indication, leur mécanisme d’action et leurs effets indésirables.
Il est habituel de distinguer le traitement d’induction, traitement périopératoire par des anticorps, du traitement d’entretien, en général trithérapie associant un inhibiteur de la calcineurine, un antimétabolite ou un inhibiteur de mTOR et un corticoïde, du traitement curatif des rejets ayant recours aux corticoïdes ou aux anticorps. Le traitement des rejets aigus médiés par les anticorps combine de façon variable les échanges plasmatiques les immunoglobulines polyvalentes et le rituximab.
Inhibiteurs de la calcineurine
La pierre angulaire du traitement d’entretien reste les inhibiteurs de la calcineurine. La ciclosporine A et le tacrolimus ont un mécanisme d’action et des caractéristiques pharmacocinétiques proches, mais des formules chimiques et des profils de tolérance différents.
La ciclosporine est un peptide de 11 acides aminés qui, après s’être lié dans la cellule à la cyclophiline, inhibe l’activité de la calcineurine et ainsi inhibe la transcription de gènes qui codent pour de nombreuses cytokines, dont l’IL-2. Même sous sa forme de micro-émulsion (Néoral®), la ciclosporine a une grande variabilité d’absorption intra- et interindividuelle avec une biodisponibilité de 40 à 60 %. Dans le sang, elle est répartie majoritairement dans les hématies et les leucocytes. Dans le plasma, elle est liée aux protéines à 90 %. Elle est métabolisée par les enzymes du cytochrome P450 3A dans le foie et l’intestin, est un substrat de la glycoprotéine P et est excrétée dans la bile avec une demi-vie de 10 à 20 heures.
Le tacrolimus (FK 506) est un macrolide qui a un mécanisme d’action similaire à celui de la ciclosporine. Le tacrolimus est 10 à 100 fois plus puissant que la ciclosporine en termes molaire. Il est caractérisé par une grande variabilité pharmacocinétique intra- et interindividuelle avec une biodisponibilité moyenne de 25 %. Les deux produits partagent de nombreux effets indésirables (tableau 2), mais l’hypertension et l’hyperlipidémie sont plus fréquentes avec la ciclosporine alors que le diabète est plus fréquent avec le tacrolimus. L’hirsutisme est un effet indésirable de la ciclosporine et l’alopécie du tacrolimus.
Les principales interactions médicamenteuses observées avec les inhibiteurs de la calcineurine sont des interactions pharmacocinétiques liées à des modifications de leur métabolisme. Les inducteurs du cytochrome P450 3A diminuent leur concentration sanguine, alors que les inhibiteurs du cytochrome augmentent leur concentration sanguine (tableau 3).
À l’inverse, la ciclosporine et le tacrolimus sont des inhibiteurs du cytochrome et modifient le métabolisme de certains médicaments. La ciclosporine augmente les concentrations sanguines des statines (surtout de la simvastatine et de l’atorvastatine) avec un risque accru de rhabdomyolyse ainsi que les concentrations de l’évérolimus et du sirolimus. La ciclosporine, à la différence du tacrolimus, diminue d’environ 30 % l’exposition des patients à l’acide mycophénolique en diminuant son cycle entéro-hépatique. De plus, il existe des interactions pharmacodynamiques avec les médicaments néphrotoxiques (AINS contre-indiqués) et les médicaments hyperkaliémiants. Les doses des inhibiteurs de la calcineurine sont, en pratique, adaptées en fonction de leur concentration résiduelle sur sang total. En raison de leur variabilité pharmacocinétique, de leurs nombreuses interactions médicamenteuses et de leur index thérapeutique étroit, leurs concentrations sanguines sont régulièrement mesurées. Les concentrations cibles diffèrent suivant le délai par rapport à la greffe, l’efficacité et la tolérance du traitement.
Antimétabolites
Le mycophénolate mofétil (MMF) a aujourd’hui largement remplacé l’azathioprine.
L’azathioprine est une prodrogue convertie en 6-mercaptopurine, convertie elle-même en un analogue des purines, qui incorporée dans l’ADN inhibe la prolifération de toutes les cellules entrées dans le cycle cellulaire. Son principal effet indésirable est sa myélotoxicité.
L’allopurinol interagit avec l’azathioprine. En inhibant la xanthine oxydase, il provoque une accumulation de 6-mercaptopurine. L’association des 2 médicaments est responsable d’agranulocytoses.
Le MMF est transformé dans l’organisme en acide mycophénolique (MPA) qui est un inhibiteur sélectif non compétitif et réversible de l’inosine monophosphate déshydrogénase. Il inhibe ainsi la synthèse de novo des purines sans être incorporé à l’ADN. Alors que la plupart des cellules peuvent utiliser la voie de sauvetage à côté de la voie de synthèse de novo des purines, la prolifération des lymphocytes dépend presque exclusivement de la voie de novo. Ainsi, le MMF a un effet cytostastique plus marqué sur les lymphocytes que sur les autres cellules. Le MMF, comme le mycophénolate sodique gastrorésistant, est absorbé presque complètement. Sa biodisponibité est supérieure à 90 %. Le MPA est métabolisé dans le foie et l’intestin principalement en un métabolite inactif, le MPAG. Dans le plasma, le MPA est lié à l’albumine à près de 99 %. Les métabolites du MPA sont éliminés par le rein. Le MPA, comme le MPAG, a une recirculation liée à un cycle entérohépatique qui explique une augmentation secondaire des concentrations plasmatiques du MPA. Le taux résiduel est mal corrélé à l’aire sous la courbe.
Les principaux effets indésirables sont digestifs (diarrhée, nausées-vomissements). Les médicaments qui interfèrent avec le cycle entéro-hépatique (cholestyramine, antiacides, ciclosporine) diminuent l’exposition au MPA. Le MMF est administré en général à dose fixe, en tenant compte de sa tolérance et son efficacité. L’intérêt de l’adaptation des doses sur les concentrations sanguines n’est pas établi.
Inhibiteurs de mTOR (mammalian Target Of Rapamycin)
Les 2 molécules utilisées sont le sirolimus (hors AMM) et l’évérolimus.
L’évérolimus et la ciclosporine ont un effet immunosuppresseur synergique. Après sa prise orale, l’évérolimus est vite absorbé avec une biodisponibilité basse de l’ordre de 20 %.
Comparé à l’évérolimus le sirolimus a une demi-vie plus longue (62 vs 28 heures) et une affinité plus grande pour la FKBP-12.
Leurs principaux effets indésirables sont indiqués dans le tableau 2. Alors que les inhibiteurs de la mTOR ne sont pas néphrotoxiques par eux-mêmes, ils potentialisent la néphrotoxicité de la ciclosporine. Ils sont associés à un retard de cicatrisation, des épanchements péricardiques et pleuraux et des infections bactériennes et fongiques.
Les inhibiteurs du cytochrome 3A4 et/ou de la glycoprotéine P augmentent les concentrations sanguines d’évérolimus et les inducteurs les diminuent. La ciclosporine augmente l’exposition à l’évérolimus. L’évérolimus n’influe pas sur la pharmacocinétique des statines (pravastatine, atorvastatine).
La surveillance des concentrations résiduelles sur sang total d’évérolimus permet d’optimiser l’efficacité du produit sur la prévention des rejets aigus et de diminuer la fréquence de certains effets indésirables. La fourchette visée est de 3 à 8 ng/ml.
Glucocorticoïdes
Les corticoïdes restent une des composantes du traitement d’induction, du traitement d’entretien et du traitement des rejets. Ils ont un effet antiinflammatoire et immunosuppresseur en modifiant l’expression de gènes codant pour des protéines impliquées dans les deux réponses.
L’utilisation des corticoïdes expose les malades à de très nombreux effets indésirables (tableau 2).
Anticorps
Certains anticorps induisent une déplétion lymphocytaire (anticorps polyclonaux antilymphocytaires et anticorps monoclonal muromonab CD3), alors que d’autres ne sont pas déplétants (basiliximab).
Les anticorps polyclonaux antilymphocytaires sont des préparations d’immunoglobulines G de lapin ou de cheval obtenues après immunisation avec des lymphocytes humains et après absorption des anticorps dirigés contre les plaquettes et les hématies. La déplétion lymphocytaire se fait par lyse complément-dépendante et par opsonisation et destruction par le système réticulo-histiocytaire. Ces anticorps sont les plus puissants des immunosuppresseurs. Ils sont utilisés comme traitement d’induction et pour le traitement des rejets corticorésistants. Leurs effets indésirables sont indiqués dans le tableau 2. La dose est fonction du poids et de la tolérance. Le traitement doit permettre d’obtenir une lymphopénie < 200/mm3.
L’anticorps muromonab CD3 est une immunoglobuline G monoclonale murine, dirigée contre l’antigène CD3 des lymphocytes T humains. Il est indiqué dans le traitement des rejets aigus corticorésistants. Ses effets indésirables fréquents et potentiellement sévères (tableau 2) ont considérablement limité son utilisation.
Le basiliximab est un anticorps monoclonal recombinant chimérique murin/humain dirigé contre la chaîne du récepteur de l’IL-2 (CD25) (figure 1). Il est utilisé (hors AMM) dans le traitement d’induction en transplantation cardiaque. Ses effets indésirables sont dominés par les réactions d’hypersensibilité. Il est administré à doses fixes.
Perspectives dans les traitements immunosuppresseurs
L’optimisation des traitements repose sur la minimisation ou l’arrêt des drogues ayant le plus d’effets indésirables (corticoïdes, inhibiteurs de la calcineurine). L’arrêt des corticoïdes à distance de la greffe permet une réduction de la fréquence de certains effets indésirables métaboliques au prix d’une augmentation du risque de rejet aigu.
La minimisation des doses d’inhibiteurs de la calcineurine le plus souvent en prévention ou en traitement d’une insuffisance rénale est possible, grâce à une augmentation des doses de MMF ou à l’introduction d’un inhibiteur de mTOR. Les données disponibles ne permettent pas de recommander aujourd’hui en greffe cardiaque le remplacement tardif et a fortiori précoce des inhibiteurs de la calcineurine par les inhibiteurs de mTOR.
De nouveaux immunosuppresseurs avec des mécanismes d’action différents sont en cours de développement ou d’enregistrement. Ils pourraient être, quant à eux, une alternative aux combinaisons actuelles basées sur les inhibiteurs de la calcineurine.
Figure 2. Rejet grade 2R avec un infiltrat de cellules mononuclées associé à une nécrose myocytaire.
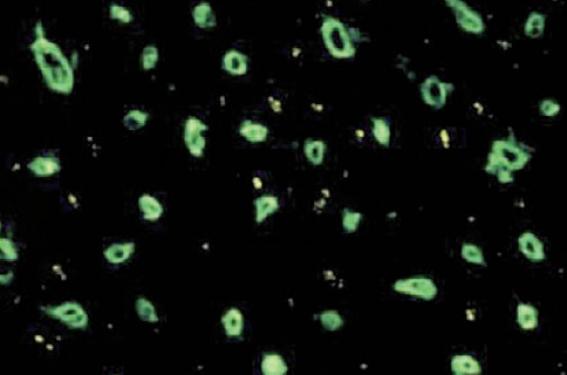
Figure 3. Rejet médié par les anticorps avec des dépôts de C4d dans les capillaires en immunofluorescence.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :







