Publié le 13 nov 2012Lecture 6 min
Obstruction ventriculaire gauche dans la cardiomyopathie hypertrophique - Mécanisme et évaluation
T. Le TOURNEAU, CHU Nantes
La cardiomyopathie hypertrophique (CMH) de type sarcomérique est une pathologie d’origine génétique fréquente (1/500), à transmission autosomique dominante. Une des particularités de la CMH est le développement d’une obstruction intra-ventriculaire gauche (VG) au repos, le plus souvent sous-aortique, chez environ 25 % des patients atteints. Il a cependant été démontré récemment que cette obstruction pouvait concerner 70 % des patients en échocardiographie d’effort après arrêt des thérapeutiques spécifiques.
Caractéristiques de l’obstruction de la CMH
Par opposition à un obstacle fixe valvulaire ou sous-valvulaire aortique, l’obstruction de la CMH se singularise par son caractère dynamique et sa variabilité en fonction des conditions de charge et de contractilité myocardique. Cette obstruction peut varier de façon importante en fonction de la prise d’aliments ou de la consommation d’alcool, de la réalisation d’un effort.
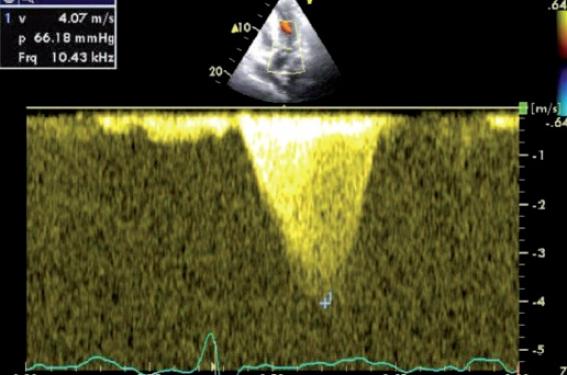
De même l’emploi de diurétiques, de vasodilatateurs (contre-indiqués en cas d’obstruction) vont augmenter l’obstruction, tandis que les inotropes négatifs (bêtabloquants, inhibiteurs calciques bradycardisants, dysopyramide) sont utilisés pour réduire le degré d’obstruction. L’aspect Doppler est caractéristique, avec une enveloppe spectrale en dent de requin marquée par un pic de vélocité tardif (late-peaking des anglo-saxons) qui permet de différencier l’obstruction de la CMH d’une membrane sous valvulaire ou d’une sténose valvulaire aortique.
On distingue deux types d’obstruction :
- l’obstruction médio-VG liée à l’hypertrophie, à l’affrontement des piliers hypertrophiés ou à l’existence de piliers anormaux. Cette obstruction médio-VG
peut séparer le VG en 2 cavités avec exclusion de la pointe (aspect en sablier).
- l’obstruction sous aortique est beaucoup plus fréquente, liée en général au mouvement systolique antérieur de la valve mitrale (SAM) qui vient s’interposer dans la chambre de chasse. Elle est responsable de symptômes chez un pourcentage important de patients, et est associée à un pronostic péjoratif (mortalité cardiovasculaire, insuffisance cardiaque, fibrillation atriale). Son rôle dans la survenue de morts subites reste discuté. Du fait de son caractère dynamique, l’obstruction de la CMH est son propre facteur d’aggravation : l’obstacle à l’éjection majore l’hypertrophie pariétale, réduit la taille de la chambre de chasse majorant ainsi le degré d’obstruction.
La prise en charge de la CMH doit donc s‘attacher à rechercher l’obstruction par des méthodes physiologiques et à mettre en place une thérapeutique adaptée pour lutter contre l’obstruction, qu’elle existe à l’état basal ou uniquement à l’effort.
Mécanisme de l’obstruction sous aortique
Le SAM de la valve mitrale est le facteur principal et princeps de l’obstruction sous aortique chez 95 % des patients. Le SAM concerne de façon prépondérante la valve antérieure mais la valve postérieure est également impliquée chez de nombreux patients. Un SAM isolé de la valve postérieure a également été rapporté.
Deux hypothèses ont été avancées pour expliquer le SAM :
- l’attraction de la valve mitrale (pulling mechanism) par un phénomène de Venturi du fait d’une accélération du flux sanguin générée par l’étroitesse de la chambre de chasse,
- le refoulement, l’entraînement de la valve mitrale (pushing mechanism) par le flux sanguin dans la chambre de chasse. Cette seconde hypothèse est la plus convaincante et est considérée comme la cause essentielle du SAM.
Un certain nombre d’anomalies morphologiques et fonctionnelles concourent à la genèse du SAM :
- la morphologie du VG avec une hypertrophie concentrique prédominant en antéro-septo basal, l’angulation entre la paroi antéro-septale et la chambre de chasse. Ces éléments morphologiques vont orienter le flux d’éjection vers la valve mitrale et l’entraîner vers la chambre de chasse ;
- l’hyperkinésie VG qui permet de maintenir le débit cardiaque en compensant la petite taille cavitaire secondaire à l’hypertrophie concentrique ;
- l’élongation anormale des valves mitrales, en particulier antérieure, qui favorise le SAM ;
- les anomalies de piliers mitraux qui sont hypertrophiés, souvent bifides (bifidité du pilier antérieur), et présentent fréquemment une position plus antérieure favorisant l’interposition de la valve mitrale dans le flux d’éjection aortique.
Enfin, il existe fréquemment des piliers ou colonnes charnues surnuméraires, en particulier en position antéro-externe, venant s’interposer dans la chambre de chasse en s’insérant sur la paroi antéro-septale ou au niveau des commissures mitrales. Ces anomalies sont en général associées à un SAM, mais peuvent être le seul obstacle à l’éjection. Leur diagnostic en échocardiographie ou par imagerie de coupe (IRM-scanner) est important car leur présence peut modifier l’attitude thérapeutique et orienter vers un geste de résection de cet obstacle anatomique.
Evaluation de l’obstruction sous aortique
Si l’examen clinique permet de soupçonner l’existence d’une obstruction sous aortique par SAM devant la découverte d’un souffle éjectionnel prédominant à l’endapex, l’échocardiographie de repos et d’effort est un examen essentiel pour le diagnostic et le suivi de l’obstruction. L’échocardiographie de repos permettra de confirmer l’obstruction et d’en faire le bilan anatomique. L’étude Doppler doit être réalisée par Doppler pulsé depuis l’apex du VG jusqu’à la valve aortique pour la localisation, et le gradient maximal sera enregistré par Doppler continu dirigé vers la valve aortique par voie apicale 5 et 3 cavités lorsque le siège de l’obstruction est sous aortique.
L’échocardiographie d’effort, réalisée sous le traitement habituel du patient, est un complément important à l’examen de repos chez la majorité des patients porteurs de CMH.
L’effort est en principe contre-indiqué lorsque le gradient maximal d’obstruction dépasse 50 à 60 mmHg au repos. Il est clairement contre-indiqué chez les patients au stade 4 de la NYHA et en cas d’hyperexcitabilité ventriculaire. Un travail récent a montré que 70 % des patients porteurs d’une CMH développent une obstruction significative à l’effort (> 30 mmHg de gradient maximal) pouvant expliquer une symptomatologie discordante avec l’examen de repos. Le gradient d’obstruction doit être enregistré pendant l’effort (effort progressif sur cycloergomètre en position semi-couchée avec surveillance ECG et TA continue) et pendant 6 minutes de récupération. Le pic de gradient est fréquemment enregistré en récupération précoce mais l’obstruction peut persister de façon prolongée après la fin de l’exercice. L’examen permettra aussi d’analyser l’adaptation du VG à l’effort et à l’obstruction, d’évaluer l’insuffisance mitrale fonctionnelle sur SAM et le niveau de pression pulmonaire. La manœuvre de Valsalva peut être réalisée mais va sous-estimer la survenue et l’importance de l’obstruction. Les autres manœuvres de provocation, de type pharmacologique, doivent être proscrites.
Le BNP n’a pas démontré son intérêt dans le diagnostic ou le suivi de l’obstruction. Par contre, le facteur von Willebrand (FVW), très sensible aux forces de cisaillement (shear stress) dont le déterminant principal est la vitesse du flux sanguin, pourrait s’avérer à terme un moyen précieux pour suivre le degré d’obstruction. Nous avons ainsi pu montrer que l’activité du FVW permet d’établir le diagnostic d’obstruction (> 30 mmHg) avec une fiabilité, une sensibilité et une spécificité de l’ordre de 90 à 95 %.
Conclusion
L’obstruction sous aortique par SAM est un composant essentiel de la physiopathologie de la CMH, responsable de nombreux symptômes, et conduisant au développement d’une insuffisance cardiaque et à une surmortalité cardiovasculaire.
Le mécanisme essentiel de cette obstruction correspond à l’entraînement dans la chambre de chasse par le flux sanguin des valves mitrales (SAM), valves qui présentent des anomalies morphologiques. La recherche et le suivi sous traitement de cette obstruction par échocardiographie de repos et d’effort sont essentiels dans la prise en charge de la CMH.
Le FVW, sensible au shear stress, pourrait être utilisé dans l’avenir comme un marqueur biologique de l’obstruction.
Figure 1. Aspect caractéristique du flux d’obstruction systolique de la cardiomyopathie hypertrophique en « lame de sabre » ou en « dent de requin » avec un pic de vitesse tardif.
Figure 2. Aspect de CMH typique avec une morphologie sinusoïdale du septum inter-ventriculaire. SAM de la valve mitrale antérieure. Noter l’élongation des valves mitrales, et le volumineux bourrelet septal qui dévie le flux d’éjection ventriculaire vers la zone de coaptation mitrale.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :