Explorations-Imagerie
Publié le 11 mar 2008Lecture 11 min
Imagerie en coupe du cœur et des vaisseaux
J. ROUSSEAU, Centre Cardiologique du Nord, Saint-Denis

2es Rencontres de la SFC et la SFR 2007
Les techniques d’imagerie cardiaque en coupes ont énormément progressé en quelques années. Elles offrent des possibilités inédites d’exploration non invasive de la physiologie et de la pathologie cardiovasculaires. Quelles sont les données scientifiques actuelles ? Quels sont les développements techniques à venir ? Mais aussi et surtout, comment intégrer ces progrès dans la prise en charge des malades en pratique ? Telles sont les questions auxquelles les secondes rencontres de la SFC et de la SFR sur l’imagerie cardiaque en coupe ont eu pour mission de répondre ! Mission accomplie sous l’impulsion des groupes de travail de cardiologues et radiologues qui œuvrent depuis 2004 à promouvoir la collaboration entre les deux disciplines.
Visualisation des artères coronaires en 2007
Place du scanner coronaire
En France en 2006, 272 000 coro-narographies et 121 000 angioplasties ont été pratiquées (registre ONACI). Trente pour cent des coronarographies ne retrouvent pas de lésions significatives, 12 % dans le groupe des syndromes coronaires aigus (SCA). Chez les patients à faible risque, on pourrait envisager de proposer un scanner coronaire, utile pour éliminer une maladie coronaire du fait de sa forte valeur prédictive négative (VPN). Quelles sont aujourd’hui les indications du TDM coronaire ?
Chez des patients non coronariens connus :
- évaluation des cardiomyopathies dilatées CMD (valeur prédictive positive : VPP entre 81 et 93 %, VPN entre 97 et 99 % pour la détection de la maladie coronaire) ;
- bilan préopératoire des valvulopathies (VPP entre 43 et 55 % et VPN entre 93 et 100 %) ;
- détection d’une insuffisance coronaire chez des patients ayant un risque faible de coronaropathie (nombreuses études avec des VPP de 80 à 98 % et des VPN de 96 à 100 % en scanner 64 barettes) . Deux études de suivi, dont l’une française, montrent le bon pronostic des patients à risque intermédiaire ayant un TDM normal, explorés pour des douleurs thoraciques avec un test d’ischémie non concluant.
Chez les patients coronariens connus :
- complément de coronarographie (exemple : évaluation de la longueur d’une occlusion chronique, visualisation de plaques complexes, anévrisme coronaire…) ;
- suivi de pontages aortocoronaires (sensibilité = 100 %, spécificité = 93 %). La TDM est indiquée : en cas d’échec de cathétérisation du pontage, de contre-indication de la coronarographie (elle-même indiquée en cas de symptômes ou de test d’ischémie positif), avant chirurgie redux pour localiser les pontages. L’analyse est rendue délicate par la petite taille des artères pontées et des pontages dysfonctionnels, la présence de clips, la FA et la tachycardie sinusale fréquente en période postopératoire (figure 1) ;
- évaluation de stents coronaire : bonne indication en fonction du diamètre du stent (stent > 3 mm : 91 % sont analysables, stent < 3 mm : 51 % sont analysables). Les performances actuelles du scanner ne permettent pas de recommander cette technique comme une alternative à la coronarographie pour le diagnostic de la sténose intrastent sauf dans le cas des stents de diamètre > 3,2 qui sont analysés avec une sensibilité de 100 % et une spécificité de 92 % (surveillance des stents du tronc commun) (figures 2 et 3).
Aux urgences, il n’y a pas d’indication de TDM dans le syndrome coronaire aigu. En revanche, le TDM est l’examen de choix pour le diagnostic de douleur thoracique en rapport avec une embolie pulmonaire ou une pathologie aortique thoracique aiguë (hématome, dissection).
Figure 1. Exemple de pontages en scanner : pontages perméables artériel (en haut à gauche) et veineux (en haut à droite). Reconstruction 3D volumique pour repérer le nombre de pontages et la topographie des anastomoses (image en bas à gauche). Sténose anastomotoique (image en bas à droite). Courtoisie Pr. Vernet).
Figure 2. Influence du type de stent (Maintz Eur radiol 2006).
Figure 3. Stent du tronc commun (courtoisie Pr Hammon).
L’étude francaise EVA-scan, première étude multicentrique, prospective évaluant « dans la vraie vie » la valeur diagnostique du TDM coronaire vs coronarographie chez des patients coronariens connus ou non, ayant un angor stable ou stabilisé, permettra de répondre plus précisément à l’apport du TDM coronaire dans la prise en charge des patients coronariens. Les résultats sont attendus pour l’ESC 2008.
En pratique pour qu’aujourd’hui les TDM coronaires soient réalisées dans de bonnes conditions il faut un partenariat cardiologue radiologue (demande de bonne qualité afin d’optimiser la lecture de l’examen et compte rendu répondant à la question clinique), une bonne communication avec le patient et une sécurité des procédures d’examen (dose de produit de contraste iodé et puissance des rayons adaptée à la corpulence, gestion de l’injection des bêtabloquants, formation du personnel en cas d’urgence, contrôle de la dose reçue par le patient).
Place de l’IRM
La place de l’IRM dans l’exploration coronaire est actuellement limitée (visualisation de l’origine des coronaires, de dilatation ou fistules…). L’IRM est moins performante que le TDM mais garde des avantages : absence d’irradiation et étude concomitante du myocarde et de la perfusion myocardique. Les équipes continuent de travailler pour améliorer les séquences avec acquisition en respiration libre : approche cookbook (acquisition inframillimétrique 3D d’un volume centré sur la coronaire gauche puis droite) ou approche Whole Heart (acquisition de tout le volume coronaire permettant d’obtenir une résolution de 0,75 x 0,54 x 0,54 avec une sensibilité de 78 %, une spécificité de 96 %, une VPN de 98 %) (figure 4).
Figure 4. Sténose serrée de l’IVA et séquelle de nécrose dans le territoire (courtoisie Dr Gerber).
D’autres séquences (coronaires en sang noir, injection de produit de contraste, imagerie à 3 Tesla) sont en développement.
Évaluation de la fonction myocardique
L’estimation de la fraction d’éjection (FE) repose quotidiennement sur l’échocardiographie. L’IRM permet également d’évaluer la fonction myocardique de façon non irradiante et fiable (la variabilité interobservateur de l’IRM pour la FE est de 2,5 versus 10 % en échocardiographie). La résolution temporelle de l’IRM est de 30 à 50 ms. Il existe des séquences d’imagerie en temps réel. Pour mesurer les volumes, le cœur est couvert de la base à l’apex sur des vues petit axe en mode ciné IRM. Chaque constructeur a développé des logiciels de quantification semi automatique permettant d’accéder au VTD, VTS et à la FE, à l’épaississement et à la masse myocardique. Les valeurs normales de masse myocardique en IRM sont 96 g/m2 chez l’homme et 77 g/m2 chez la femme.
L’analyse segmentaire s’effectue visuellement mais peut aussi s’apprécier par la mesure des déformations (épaississement radial, raccourcissement longitudinal et circonférentiel), grâce aux taggs qui suivent les déformations myocardiques au cours du cycle cardiaque. Le logiciel HARP et la cartographie des vitesses tissulaires myocardiques basée sur le déphasage des spins (TPM) permettent de réaliser automatiquement l’étude des déformations. L’imagerie en tenseur de diffusion (DTMRI) permet de visualiser les mouvements des fibres cardiaques (figure 5).
Enfin, l’imagerie de contraste de phase donne accès au flux : sur l’aorte, il permet d’évaluer le débit transaortique ; sur la mitrale, il permet de visualiser le flux de remplissage mitral (donc d’étudier la fonction diastolique).
Figure 5. Imagerie des fibres myocardiques en IRM (Helm Ann NY acad sci 2005).
La FE en TDM est bien corrélée à la FE obtenue en IRM, mais au prix d’une irradiation systolique qui pose problème pour recommander cette étude en routine.
Les principales applications de l’IRM sont les suivantes.
La cardiopathie ischémique
Détection de l’ischémie
Elle est possible par l’étude en IRM de la cinétique sous dobutamine (Se et Sp de 86 % chacune). Les effets secondaires rythmiques sont rares : 1 TVS, 4 TVNS, 16 AF et 2 BAV ont été rapportés chez 1 000 patients explorés par IRM dobutamine. Pour des raisons de facilité d’utilisation dans l’aimant, l’étude de la perfusion sous vasodilatateur type adénosine ou dipyridamole, s’est développée (Se 90 Sp 85 %). Le principe est le même qu’en scintigraphie, mais sans irradiation, sans artefact d’atténuation ou de BBG, avec une haute résolution spatiale et une réalisation en 40 min (pas de redistribution à 4 h). Les problèmes liés à la technique sont les artefacts d’off résonance (septum), les faux positifs et la nécessaire courbe d’apprentissage de la méthode. Un test négatif est de bon pronostic à 1 an (VPN de 100 %). Ses indications sont :
- examen diagnostique de 2e ligne après une épreuve d’effort douteuse ou si la FMT n’ a pas été atteinte ;
- examen permettant de localiser et quantifier l’étendue de l’ischémie (par exemple pour la stratification du risque avant chirurgie extracardiaque) (figure 6).
Figure 6. Comparaison scintigraphie myocardique et IRM de perfusion sous stress pharmacologique (courtoisie Pr Garot).
Détection de la viabilité
La viabilité est définie par la récupération fonctionnelle d’un territoire après revascularisation. Il existe deux façons de l’étudier en IRM :
- étude du rehaussement tardif. La cicatrice d’infarctus trappe le gadolinium et apparaît en hypersignal lors des séquences tardives, 10 minutes après injection de gadolinium. La résolution spatiale est excellente. Une nécrose transmurale n’est pas viable, une nécrose non transmurale est partiellement viable, un infarctus sans séquelle de nécrose est complètement viable. Il y a une proportionnalité entre la récupération et le pourcentage de myocarde dysfonctionnel mais viable (figure 7) ;
- étude de la cinétique sous faible dose de dobutamine, comme en échocardiographie.
Figure 7. Correlation entre IRM et coupe anatomique (Kim 1999).
La technique a une bonne sensibilité et spécificité, en particulier dans les cas intermédiaires avec le rehaussement tardif (rehaussement de l’ordre de 50 %).
La viabilité au TDM peut être évaluée par le scanner car le produit de contraste iodé suit la même distribution tissulaire que le gadolinium ; néanmoins les images sont de qualité inférieure à l’IRM qui reste la référence.
Myocardites
Le diagnostic de certitude de myocardite est complexe, reposant sur une atteinte histologique multifocale ou diffuse documentée par biopsie. L’IRM réalise une analyse morphologique et une caractérisation tissulaire multicontraste qui permet de visualiser les zones atteintes (les biopsies y sont positives). L’étude perfusionnelle permet dans le même examen d’éliminer un infarctus du myocarde (hypersignal tardif de localisation sous endocardique).
Les atteintes myocarditiques ne sont pas systématisées, nodulaires ou diffuses, épicardiques, avec des anomalies de la cinétique non concordantes. Les images ciné post-gadolinium permettent de voir précocement les hypersignaux en rapport avec l’inflammation. Les séquences tardives sont des séquences d’inversion-récupération qui éteignent le myocarde sain. Le choix du TI peut être difficile dans les formes diffuses.
Marholdt a pu montré que les parvovirus donnent un tableau avec localisation inférolatérale des lésions mimant un SCA alors que les herpesvirus se manifestent par une fatigue et dyspnée avec des lésions plutôt antéroseptales. L’IRM sera réalisée au mieux dans les 5 jours suivant le début des symptômes.
CMH
L’imagerie a pour but de localiser l’hypertrophie (diagnostic parfois difficile dans formes apicales en échographie), sa progression, les effets du traitement. Le rehaussement tardif est corrélé à l’épaisseur myocardique et la masse, et est inversement proportionnel à la FE. L’aspect en motte est caractéristique. Un aspect de rehaussement diffus est associé à un risque accru de mort subite. L’IRM aide au diagnostic de sarcoïdose ou d’amylose associée (figure 8).
Figure 8. CMH sous aortique et CMH apicale (A). Rehaussement tardif dans l’hypertrophie (B). (courtoisie Pr Crochet).
CMD
L’apport de l’imagerie en coupe est potentiellement multiple :
- diagnostic (non compaction, myocardite, aspect de CMD ischémique ou inflammatoire…) ;
- recherche de complications (anévrisme, faux anévrisme, thrombus…) (figure 9) ;
- suivi sous traitement (volume, FE, masse, fibrose…) ;
- perspectives : étude de la désynchronisation, aspect pronostique de la fibrose…
Figure 9. Thrombus tapissant un anévrisme ventriculaire inférieur (courtoisie PR Chabbert).
Fonction VD
Le VD est de morphologie et de dynamique complexe. En IRM, la fonction VD est estimée par mesure du VTD VD, VTS VD, de la FE VD, de la masse (sans modèle géométrique préalable) et par l’analyse la cinétique segmentaire. La variabilité interobservateur de l’analyse est de 8 % environ. La FE VD normale est de 53-62 % et VTD 71- 78 ml/m2 selon les séries. Les principales pathologies du VD étudiées en IRM sont :
- dysplasie arythmogène du VD (DAVD) (figure 10) ;
- HTAP (dilatation et hypertrophie VD, diminution de la fonction systolique, hyper signaux à la jonction VD VG sur les séquences tardives). Les mesures de PAPs par imagerie de contraste phase ne sont pas fiables ;
- cardiopathies congénitales (Fallot opérés, TGV) : évaluation de la fraction de régurgitation de l’insuffisance pulmonaire (IP), akinésie ou anévrisme de l’infundibulum pulmonaire, suivi du volume et de la fonction VD ;
- IDM étendus au VD.
Figure 10. DAVD : dilatation du VD, hyper signaux de la graisse intramyocardique (A) amincissement ou hypertrophie pariétale, micro- anévrisme (B), rehaussement tardif (C). Tandri jacc 2005.
Péricarde
Dans la péricardite, l’imagerie en coupe vient compléter le bilan en cas de difficulté diagnostique ou thérapeutique ou en cas de tableau chronique (recommandations ESC 2004). Le TDM est très utile pour visualiser les calcifications et mesurer l’épaisseur péricardique. L’IRM permet une analyse morphologique et dynamique : cinétique diminuée du péricarde, fasseyement du septum, bombement du septum en inspiration, retentissement sur la veine cave sans dilatation du VD. Elle recherche des lésions associées : épicardite post-radique, tumeur cardiaque, IDM, calcification intramyocardique (BK), atteinte pleurale ou pulmonaire (figure 11).
Figure 11. Epaississement du péricarde visible sur le scanner (A) et l’IRM (B) ; calcification péricardique (C) (Courtoisie Pr Mousseaux).
Aorte
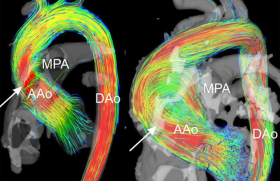
L’IRM et, surtout, le TDM occupent une place fondamentale pour le diagnostic des syndromes aortiques aigus, pour les décisions thérapeutiques (dimensions de l’aorte initiale, visualisation de bicuspidie, bilan avant mise en place d’une endoprothèse aortique, porte d’entrée et complications de la dissection aortique…) et pour la surveillance postopératoire (figure 12).
Figure 12. Endoprothèse aortique (Courtoisie Pr Rousseau).
Valvulopathies
L’imagerie en coupe s’essaye à l’exploration des valvulopathies avec des résultats encourageants sur de petits effectifs. La TDM permet diverses planimétries (insuffisance aortique, rétrécissement aortique, rétrécissement mitral). L’IRM donne des informations sur la valve et sur le retentissement de la valvulopathie : étude des volumes éjectés et régurgités, quantification des insuffisances aortique et pulmonaire, étude de la Vmax d’un RA (figures 13).
Figure 13. Planimétire aortique en scanner (Laissy, Heart 2007).
Perspectives
Sur le plan technologique, les améliorations sont constantes. En TDM, les efforts portent avant tout sur les stratégies de diminution de dose, en particulier la modulation de la dose (minimum de dose pendant la systole) et l’acquisition prospective (système step and shot et snap shot, qui diminue la dose jusqu’à 70 %). Par ailleurs, un constructeur développe l’acquisition en une séquence prospective grâce à un scanner 256 barrettes.
En IRM, les développements visent à réaliser des acquisitions plus rapides (4D trak, interpolation des phases, acquisition radiale) et à augmenter le signal et la qualité des images (imagerie à haut champs 3 Tesla). Les consoles de travail évoluent pour faciliter la quantification automatisée des principaux paramètres. L’imagerie de fusion progresse : cartographie électrophysiologique et TDM ou IRM des veines pulmonaires, scanner coronaire et scintigraphie myocardique (figure 14).
Figure 14. Imagerie de fusion entre le scanner coronaire et la scintigraphie myocardique de stress (Gaemperli O, Eur J Nucl Med Mol Imaging, 2007).
Sur le plan scientifique, l’un des enjeux est la visualisation des plaques athéromateuses à risque de rupture. La TEP a montré son intérêt sur l’étude des plaques carotidiennes mais sa résolution est trop faible pour l’étude des coronaires, tout comme l’IRM. Le TDM est très performant mais ne dispose pas encore d’agent de contraste spécifique validé. Des travaux sont en cours dans ces différents domaines.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :