Valvulopathies
Publié le 08 juin 2004Lecture 5 min
Le point sur les valves mécaniques - Le point de vue du cardiologue
A. PAVIE, CHU Pitié-Salpêtrière, Paris
En 2004, le remplacement valvulaire par une valve mécanique demeure l’éventualité la plus fréquente en chirurgie valvulaire (environ 60 % du marché français). Cependant, plus de 40 ans après le premier remplacement valvulaire, la valve idéale — non obstructive, continente, inaltérable, qui n’altère pas les constituants du sang, ne thrombose pas, est facile à insérer et est bien tolérée par le malade — n’existe toujours pas ; néanmoins, de nombreux types de valves, en particulier mécaniques, qu’elles soient à bille, à disque ou à ailettes, se rapprochent de ces objectifs.
Pour les plus jeunes des lecteurs, et en raison de malades ayant des valves posées depuis plusieurs dizaines d’années que vous pouvez être amenés à suivre, il est nécessaire au préalable de faire un bref rappel historique.
Rappel historique
• C’est, dès 1952, avant l’avènement de la circulation extracorporelle (CEC), que Hufnagel a eu l’idée et a réalisé l’implantation d’une valve à cage, dans l’aorte descendante.
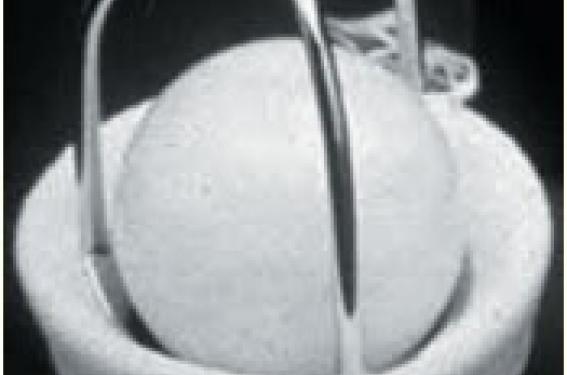
• Puis, avec l’avènement de la CEC, en 1960, sont apparues les valves à bille : les valves de Harken, Braunwald, Smelloff Cutter et surtout Starr (figure 1). Cette dernière, en particulier le modèle à bille de silastène, a sauvé de nombreux malades et a permis le développement de la chirurgie valvulaire. L’excellente durabilité de ce modèle a pour conséquence que de nombreux malades sont encore porteurs de cette valve, dont l’implantation a cessé en France depuis environ 10 ans.
Figure 1. Valves à bille.
A. Starr Edwards à bille de silastène.
B. Smelloff Cutter.
• Quasiment en même temps sont apparues les valves à disque, tout d’abord à mouvement vertical (valve de Beall), puis en 1969-70, les modèles à disque pivotant de Björk-Shiley® et de Lillehei-Kaster® (figure 2). L’introduction du carbone pyrolytique au niveau des disques a permis la réalisation des valves de seconde génération : Björk-Monostrut®, Medtronic Hall®, All carbon Sorin® et Omnicarbon® (figure 3). La construction monobloc de l’anneau et des arceaux a permis d’obtenir une excellente durabilité ainsi que de bonnes performances hémodynamiques, en particulier au niveau de l’orifice aortique dans les petits diamètres.
Figure 2. Valves à disque première génération.
A. Valve de Beall.
B. Valve de Björk-Shiley.
C. Valve de Lillehei-Kaster.
Figure 3 : Valves à disque de deuxième génération.
A. Björk-Monostrut.
B. All carbon Sorin.
C. Omnicarbon Medical Inc.
D. Med Hall Medtronic.
• Si, historiquement, les premières valves à ailettes ont été envisagées, également en 1960, par Gott ainsi que par Kalke et Lillehei, il a fallu attendre réellement 1977 pour voir apparaître la valve Saint-Jude® (figure 4), qui fait toujours référence aujourd’hui, puis, successivement, la valve Carbomedics®, en 1986, celle de Sorin (Bicarbon®), en 1990, suivie de la valve ATS® en 1992 et, plus récemment, la valve Mira (Edwards®), la valve ON-X® et la valve Advantage® de Medtronic, en 2003. Leurs excellentes performances hémodynamiques, jointes à leur durabilité en ont fait progressivement le type de valve de référence, en particulier au niveau mitral.
Figure 4. Valves à ailettes.
A. Saint-Jude.
B. Carbomedics.
C. ATS.
D. Bicarbon Sorin.
E. Mira Edwards.
F. ON-X MCRI.
G. Advantage Medtronic.
Pour tous ces modèles, l’élément mobile est en carbone, l’anneau et les articulations sont construits en monobloc, le dessin vise à optimiser l’orifice utile, le degré d’ouverture, ainsi qu’à réduire les zones de stagnation et le niveau sonore, et à les rendre orientables. L’anneau de suture fait également l’objet de tous les soins visant à essayer de l’adapter aux différentes situations anatomiques rencontrées : allant de l’anneau ultrafin pour les petits anneaux aortiques destinés à augmenter le diamètre utile, aux anneaux au contraire larges pour les réinterventions mitrales, en passant par les anneaux standard permettant des implantations intra- ou supra-annulaires.
Complications et durabilité
Complications hémorragiques
Le taux linéarisé de complications hémorragiques est de 1,9 à 2,3 pour 100 patients/années en position aortique et de 1,7 à 3 pour les valves mitrales. Malgré la standardisation des moyens de surveillance avec l’INR, les hémorragies demeurent trop fréquentes. Des remèdes existent cependant comme nous le montrent nos confrères germaniques :
- renforcement de l’information de nos malades, certainement encore très insuffisante, ainsi que de nos collègues généralistes,
- réduction du niveau d’INR sous autocontrôle personnalisé du malade (études ESCAT I et II). L’utilisation de l’autocontrôle permet de réduire ces accidents en diminuant la variabilité de l’INR, tout en augmentant le confort du malade.
Thrombose de valve
Elle demeure excessivement grave. Il faut y penser systématiquement devant toute aggravation de la symptomatologie en postopératoire, en ayant présent à l’esprit un dogme chirurgical : « Chez un malade opéré, la survenue d’un nouvel événement ou complication est suspecte d’être en rapport avec l’intervention, jusqu’à la preuve du contraire ». Néanmoins elle est rare, beaucoup plus fréquente en position mitrale qu’aortique.
C’est l’échocardiographie transthoracique, et le plus souvent transœsophagienne, qui fera le diagnostic en montrant une image de caillot, mais dans le cas des valves à ailettes en objectivant le blocage de l’une d’entre elles, soit une ouverture incomplète ou un asynchronisme.
Accidents thromboemboliques
Leur incidence est de 1,2 à 2,5 pour 100 patients/années, plus élevée en mitral qu’en aortique, avec d’importantes variations d’une série à l’autre.
Endocardite sur prothèse
Ce risque est clairement identique pour tous les types de valves et semblable à celui des bioprothèses. Il est faible, 0,8 % patients/années. L’éducation et la prophylaxie restent les meilleures protections contre cette redoutable complication.
Défaillances structurelles
Elles sont exceptionnelles, grâce aux modifications apportées à la fabrication des valves mécaniques de deuxième génération (carbone pyrolytique, usinage monobloc).
Défaillances non structurelles
Bien que rares, les défaillances à type de pannus peuvent survenir. Il s’agit du processus d’endothélialisation normal qui dépasse son but. Il faut y penser devant l’augmentation des gradients transvalvulaires à long terme (> 10 ans).
Désinsertion
Elle n’est pas plus fréquente sur les valves mécaniques que sur les biologiques. Elle tient plus aux conditions anatomiques locales, telles que calcifications massives, tissus dystrophiques, indépendamment de l’endocardite.
Hémolyse
C’est également une complication possible mais rare, souvent liée à une petite désinsertion. Ce n’est que sa sévérité qui pourra imposer une réintervention, repoussée dans la mesure du possible après la phase inflammatoire initiale, c’est-à-dire au-delà de 6 mois.
Quelle valve pour quel malade ?
La valve mécanique reste le gold standard compte tenu de sa fiabilité, de son excellent profil hémodynamique et de sa durabilité. Les contraintes du traitement anticoagulant sont minimes au quotidien. L’utilisation de ces valves est cependant toujours à discuter pour chaque malade en fonction des autres possibilités techniques : valves biologiques stentées ou non, homogreffes.
Le choix d’une valve dépend :
- de l’orifice : aorte, mitrale, tricuspide,
- de la pathologie : sténose, fuite, endocardite,
- de l’anatomie : taille de l’anneau, du cœur, présence de calcifications, degré d’hypertrophie, etc.,
- de la disponibilité du matériel,
- de l’expérience du chirurgien.
Résultats
La mortalité opératoire n’est pas significativement différente suivant le modèle de prothèse implantée, mécanique ou biologique. Elle reste dépendante des lésions valvulaires à corriger et surtout de l’existence ou non de lésions coronaires associées (tableau 1) ainsi que des facteurs de risque associés (tableau 2), éléments à prendre en compte lors de la pose de l’indication opératoire.
Conclusion
La valve mécanique reste le substitut valvulaire le plus utilisé en raison de sa fiabilité. Un contrôle strict du traitement anticoagulant, en impliquant de façon plus étroite le malade et le généraliste, devrait permettre de réduire de façon importante le risque hémorragique tout en évitant les accidents emboliques.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :