Échocardiographie
Publié le 07 fév 2006Lecture 7 min
L'échocardiographie en réanimation cardiaque
C. SCHEUBLÉ, Centre Cardiologique du Nord, Saint-Denis
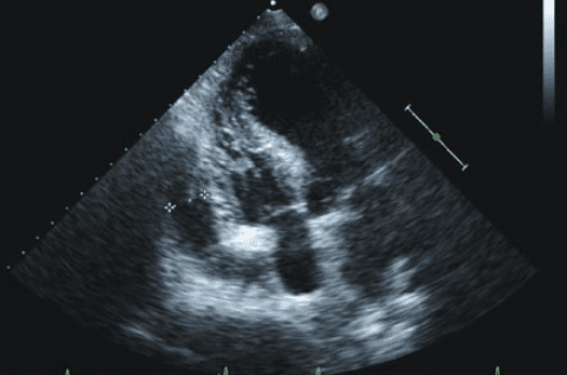
L’échocardiographie en réanimation cardiaque permet une qualification précise de l’état circulatoire et des éventuelles corrections thérapeutiques à apporter et répond aux problèmes diagnostiques suscités par certaines circonstances spécifiques comme la période postopératoire de la chirurgie cardiaque.
L’échographie cardiaque apporte au réanimateur des éléments de réponse essentiels sur les mécanismes et les causes des situations de défaillance hémodynamique ou respiratoire, et devient souvent l’examen décisionnel pour l’ajustement des traitements.
Dans les situations de défaillance hémodynamique et/ou respiratoire, ou bien après chirurgie coronaire ou valvulaire, le réanimateur médical ou chirurgical peut obtenir, grâce à l’échographie cardiaque, des éléments de réponse immédiatement accessibles portant sur huit paramètres qui doivent faire l’objet d’une étude systématique :
• la fonction VG segmentaire et globale,
• le degré de remplissage,
• le péricarde,
• la fonction ventriculaire droite,
• le fonctionnement des substituts valvulaires,
• la présence d’un obstacle dynamique intra-VG,
• la présence d’un shunt,
• une thrombose cavitaire.
L’examen transthoracique sera associé à une injection de contraste et complété éventuellement par un examen transœsophagien.
Détection d’un épanchement péricardique
L’épanchement péricardique (figure 1) doit être évoqué devant tout état de choc et/ou de défaillance respiratoire. Il est facilement diagnostiqué lorsqu’il est abondant, circonférentiel et compressif (tableau). Certains pièges doivent être évités :
• la surestimation du retentissement sur les cavités en cas d’hypovolémie (intérêt de la mesure de la VCI),
• la sous-estimation en cas de dilatation des cavités droites consécutive le plus souvent à une pathologie respiratoire,
• la difficulté parfois de différencier l’épanchement péricardique de l’épanchement pleural gauche. En cas d’hypertrophieventriculaire gauche, un épanchement péricardique d’abondance, même modérée, peut être très mal toléré et responsable d’un tableau clinique de défaillance circulatoire par tamponnade.
Figure 1 A et B. Épanchement péricardique le long des cavités droites (en haut) avec diminution des variations inspiratoires de la veine cave inférieure (en bas).
L’épanchement péricardique localisé est difficile à reconnaître en postopératoire immédiat. C’est le cas lorsqu’il siège en arrière de l’oreillette gauche (OG) ou de l’oreillette droite (OD) ou lorsqu’il est haut situé vers l’AP. Il faut s’aider de l’injection de microbulles obtenues par agitation de soluté de perfusion puis administrées par voie intraveineuse dans les cavités droites pour visualiser un « moulage » de l’OD, du VD et du tronc de l’AP. L’ ETT sera complétée par un examen transœsophagien ou un scanner thoracique sans injection.
Détection d’un hématome médiastinal
Après chirurgie cardiaque, un hématome médiastinal compressif doit être évoqué en cas d’arrêt prématuré ou de réduction inhabituelle du débit des drains médiastinaux, en particulier si des signes d’insuffisance circulatoire sont présents (hypotension réfractaire, oligurie…). Il peut s’agir d’une collection périaortique après chirurgie de l’aorte ascendante type Bentall ou d’une collection médiastinale antérieure rétrosternale, parfois difficile à différencier d’un épanchement péricardique qui lui est souvent associé. La collection peut avoir un aspect hétérogène, lié à un caillotage en cours d’organisation. En cas de doute, une ETO et un scanner peuvent compléter l’ETT, et une reprise chirurgicale est envisagée si l’état du patient est préoccupant.
Les fonctions ventriculaires gauche et droite ainsi que l’état volémique doivent être évaluées simultanément
Dans le contexte de la réanimation postopératoire en particulier, les données de l’EC doivent tenir compte du niveau de support inotrope et/ou vasopresseur pharmacologique (dobutamine, adrénaline, noradrénaline), d’une assistance par contre-pulsion intra-aortique éventuelle, des paramètres de la ventilation assistée et notamment du niveau de pression positive. L’EC précise la cinétique segmentaire du VG puis la fonction systolique globale (estimation visuelle, calcul par les scores, méthode de Simpson), ainsi que le débit cardiaque à partir de l’intégrale temps vitesse (lTV) aortique ou pulmonaire. L’échocardiographie apprécie la taille des cavités droites en comparaison des cavités gauches, recherche un mouvement septal paradoxal, un gradient intra-VG et mesure la pression artérielle pulmonaire.
Quelques situations particulières
Après plastie mitrale, toute instabilité hémodynamique fait rechercher un obstacle à l’éjection du VG lié au déplacement antérieur de l’appareil valvulaire mitral en systole (SAM {systolic anterior motion}), ce qui peut survenir si le point de coaptation est trop antérieur, majoré par une hypovolémie. Dans cette situation, l’introduction d‘un bêtabloqueur sera envisagée.
L’hypoxémie inexpliquée doit faire évoquer un shunt droit-gauche. La voie sous-costale avec injection IV de contraste doit être systématique lors de l’ETT d’un patient de réanimation. Le plus souvent, il s’agit d’un foramen ovale perméable avec shunt droit-gauche secondaire à une élévation des pressions droites au cours d’une défaillance VD ou d’un cœur pulmonaire aigu, ou encore d’un hématome comprimant les cavités droites.
L’instabilité hémodynamique après remplacement valvulaire impose de rechercher une dysfonction du substitut valvulaire. Le mouvement des éléments mobiles d’une prothèse mécanique est difficile à voir en ETT et s’apprécie au mieux par l’ETO. L’élévation anormale du gradient d’une prothèse n’est pas systématiquement synonyme de thrombose de valve, toute mesure du gradient devant tenir compte de la fréquence cardiaque, du taux d’hémoglobine et du diamètre de la prothèse. Les fuites pathologiques sont périprothétiques et associées habituellement à une désinsertion partielle de la prothèse (segment postérieur de l’anneau aortique par exemple). Une fuite massive doit faire évoquer un blocage d’une ailette, en association avec une thrombose obstructive, ou une dysfonction primaire de la prothèse.
Le patient fébrile en réanimation, porteur d’un souffle ou d’une prothèse ou après chirurgie valvulaire est suspect d’endocardite. L’ETT et l’ETO apportent les éléments de confirmation du diagnostic et recherchent les facteurs de gravité (taille et mobilité des végétations, abcès de l’anneau, dysjonction mitro-aortique, fuite paraprothétique). L’endocardite n’est toutefois pas la seule cause cardiaque de fièvre identifiée par l’échographie. Une thrombose de valve (figure 2), une thrombose cavitaire ou un hématome médiastinal postopératoire s’accompagnent de fièvre parfois élevée et prolongée.
Figure 2. Thromboses intraauriculaires après remplacement valvulaire mitral.
Chez le patient anurique, l’échographie recherche méthodiquement les causes de défaillance hémodynamique liées au cœur gauche ou au cœur droit décrites précédemment. Une attention particulière est portée à l’étude du péricarde et du médiastin à la recherche d’une compression localisée d’une cavité par une tumeur médiastinale ou par un épanchement liquidien (figure 3 A et B, sans et avec contraste droit). L’ETO recherche enfin une thrombose cavitaire ou un athérome aortique, source possible d’embolie rénale ou digestive.
Figure 3. A. écho 4 postopératoire sans injection de contraste IV. B. Même écho : avec injection de contraste non-iodé IV. Écrasement de l’OD par un épanchement péricardique postopératoire.
Le point de vue du réanimateur
Il est aujourd’hui admis que le monitorage hémodynamique d’un patient de réanimation cardiaque ne repose plus uniquement sur la mesure sanglante des débits et pressions. L’échocardiographie s’est peu à peu imposée en complément puis en remplacement du cathéter de Swan-Ganz et la plus grande limite à son usage systématique apparaît être la disponibilité du matériel et la formation des équipes.
De nouveaux indices de l’état volémique ?
Apprécier l’état volémique d’un patient de réanimation en ventilation assistée reste un souci permanent. Jusqu’à présent les indices proposés se heurtaient à des difficultés techniques et théoriques qui les rendaient peu utilisables et imprécis. Par exemple, la mesure de la surface télédiastolique du VG en incidence petit axe, largement étudiée en anesthésie, bien qu’assez reproductible, manque de sensibilité et ne permet en définitive de déceler une hypovolémie que dans des situations caricaturales.
Une approche physiopathologique originale, fondée sur l’analyse des interactions cardio-pulmonaires apporte de réels progrès. L’idée est d’observer les conséquences sur le retour veineux (RV) des variations de pression intrathoracique (Pit) induites par les cycles respiratoires et d’en déduire un état de précharge dépendance ou non.
Ce concept, illustration des courbes de Guyton et de Starling, paraît novateur en permettant une réponse dichotomique à partir de paramètres simples et reproductibles.
Sans entrer dans les subtilités de la ventilation mécanique sur les performances cardiaques, on admet que l’augmentation de la Pit lors de l’insufflation oppose une contrainte supplémentaire au RV. Si cette contrainte apparaît suffisante pour diminuer significativement le retour veineux (RV), elle permettrait de démasquer un état de volo-dépendance authentifié par une augmentation du débit cardiaque après remplissage.
Pour cela, la veine cave inférieure étudiée en ETT (figure 4) par voie sous-costale est utilisée comme marqueur du retour veineux, et l’ITV aortique pour calculer le débit cardiaque. On définit un index de distensibilité (dIVC) égal au diamètre en fin d’insufflation (Dmax ) moins ce même diamètre en expiration (Dmin) divisé par Dmin soit : (Dmax - Dmin)/Dmin = dIVC.
Figure 4. Variations de diamètre de la veine cave inférieure d’un patient en ventilation assistée. E = expiration ; I = inspiration.
Un seuil de variation > 18 % prédit une réponse positive définie comme une augmentation du DC de plus de 15 % avec une sensibilité de 90 % et une spécificité de 90 %. De plus, l’amplitude de l’augmentation du débit cardiaque est proportionnelle à dIVC. Le même raisonnement peut-être appliqué à la veine cave supérieure (VCS) en se souvenant que ce vaisseau intrathoracique est directement soumis à la Pit et par conséquent, une diminution du RV se traduit par une réduction de calibre à l’inverse de la VCI. Un même index de distensibilité peut être calculé, dont l’analyse serait peut-être même facilitée en raison d’une ligne de partage nette liée à une réponse de type on-off.
Toutefois, si ces index paraissent prometteurs, il faut souligner qu’ils n’ont été étudiés que chez les patients septiques de réanimation, en ventilation mécanique, chez lesquels la prévalence de l’hypovolémie est particulièrement importante. Il ne sont donc pas transposables de principe à tous les patients, notamment ceux en ventilation spontanée dont le régime de pression intrathoracique est inversé.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :







