Rythmologie et rythmo interventionnelle
Publié le 21 nov 2006Lecture 7 min
Prévention de la FA : une efficacité des médicaments « non antiarythmiques » ?
S. LÉVY, G. CHICHE et P. SBRAGIA, hôpital Nord, Marseille
Si le mécanisme par lequel ces médicaments (IEC et ARAII) pourraient prévenir la FA n’est pas complètement élucidé, un certain nombre de données expérimentales et cliniques récentes militent en faveur de leurs effets bénéfiques dans le développement de la FA (prévention primaire) et de la prévention des récidives (prévention secondaire). Une autre classe de médicaments pourrait jouer un rôle dans la FA : les statines, dont le rôle est soutenu par leurs effets antiinflammatoires et la prévention de la fibrose sur des modèles expérimentaux. Mais les études cliniques sont peu nombreuses et leurs résultats sont contradictoires. Aussi nous limiterons cette mise au point au rôle des IEC et des ARAII dans la prévention de la FA.
Les effets bénéfiques de l’inhibition du système rénine-angiotensine (SRA) dans les traitements de l’hypertension artérielle et de l’insuffisance cardiaque, ainsi que dans la prévention du diabète sont connus depuis longtemps. En revanche, les effets des IEC et des ARAII dans la prévention de la fibillation auriculaire (FA) n’ont été appréhendés que cette dernière décennie. Plusieurs études ont, en outre, montré que ces médicaments peuvent prévenir le développement de la FA et la survenue d’accidents vasculaires cérébraux (AVC). En dernier lieu, le rôle des statines dans la prévention de la FA est également évoqué mais son évaluation n’en est encore qu’au stade préliminaire.
SRA et FA
La rénine, secrétée par l’appareil juxta-glomérulaire rénal, est une protéase qui permet la conversion de l’angiotensinogène en angiotensine I. L’angiotensine I est convertie au niveau du poumon par l’enzyme de conversion de l’angiotensine, en angiotensine II. L’angiotensine II est un puissant vasoconstricteur, qui se lie au niveau du cœur et du rein à la protéine G des récepteurs de type 1 et 2 (AT1 et AT2). Les récepteurs AT1 modulent l’effet vasoconstricteur de l’angiotensine II et l’hypertrophie vasculaire et cardiaque. Les récepteurs AT2 ont les effets inverses. L’angiotensine II stimule aussi la sécrétion d’aldostérone par les glandes surrénales. Elle intervient dans la croissance cellulaire en stimulant l’hypertrophie des cellules myocardiques, l’apoptose (ou mort cellulaire) et la fibrose. L’angiotensine II diminue aussi la synthèse du NO (nitric oxide) des vaisseaux sains et intervient ainsi dans le tonus vasomoteur.
L’enzyme de conversion agit aussi sur deux protéines vasodilatatrices : la bradykinine et la kallidine. Ainsi, l’inhibition de l’enzyme de conversion agit sur la tension artérielle en évitant la formation d’angiotensine II et en potentialisant l’action vasodilatatrice de la bradykinine.
Études expérimentales
Des études expérimentales suggèrent que les IEC pourraient jouer un rôle dans la FA. Plusieurs de ces études viennent du laboratoire de Stanley Nattel à Toronto (Canada) et ont montré que les IEC et les ARAII inversent ou atténuent les modifications entraînées par le remodelage auriculaire expérimental obtenu par stimulation auriculaire rapide ou par stimulation ventriculaire rapide sur un modèle d’insuffisance cardiaque chez l’animal.
Remodelage auriculaire
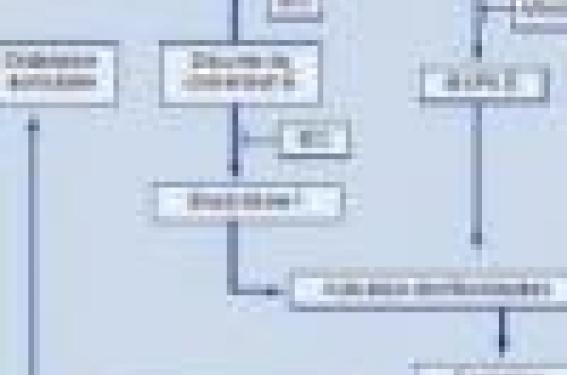
Le rôle essentiel des IEC et les ARAII est l’atténuation du processus de remodelage auriculaire (schéma). Le remodelage électrique auriculaire désigne les modifications que subit l’oreillette une fois la FA installée et qui tendent à la rendre permanente. Il est caractérisé par un raccourcissement des périodes réfractaires effectives de l’oreillette (PRE) avec inadaptation de ces PRE au cycle cardiaque. Le remodelage électrique auriculaire s’accompagne d’une surcharge en calcium liée à la réduction du courant calcique (LCa++) mettant en jeu la survie des cellules myocardiques. Le prétraitement par une perfusion de candésartan ou de captopril de chiens anesthésiés montre que la stimulation auriculaire très rapide (800/min pendant 180 min) s’accompagne d’un raccourcissement des PRE de 4 % avec maintien de l’adaptation de la PRE au cycle cardiaque alors qu’elle est de 11 % en moyenne avec perte de l’adaptation de la PRE au cycle cardiaque, dans les groupes d’animaux perfusés par du sérum physiologique ou de l’angiotensine II.
Schéma. Mécanisme d’action des IEC et des ARAII dans la FA.
Formation de fibrose
Le blocage de l’enzyme de conversion de l’angiotensine par les IEC diminue le taux de l’angiotensine II. L’angiotensine II stimule les MAPK (mitogen-activated protein kinase) qui activent les fibroblastes et la formation de fibrose, participant ainsi au remodelage structurel de l’oreillette (schéma). Les patients dont la FA est persistante ont d’ailleurs un niveau d’activation des MAPK supérieur à celui des patients avec FA paroxystique. Il est important de souligner que la densité des récepteurs de l’angiotensine II est plus élevée au niveau auriculaire qu’au niveau ventriculaire.
Les IEC réduisent aussi la formation de bradykinine qui joue également un rôle dans l’activation de fibroblastes et la formation de collagène. Les bloqueurs des récepteurs du type 2 de l’angiotensine II empêchent la stimulation des MAPK et, de ce fait, la fabrication de fibrose. Il est bien connu que la fibrose entraîne une hétérogénéité de la conduction auriculaire qui, elle-même, favorise la FA. Par ailleurs, la FA, une fois installée, entraîne une distension auriculaire (stretch) qui stimule la sécrétion d’enzyme de conversion. D’après l’équipe de Stanley Nattel, l’insuffisance cardiaque expérimentale augmente l’angiotensine II auriculaire et l’expression des MAPK, et la surcharge calcique qui accompagne la FA, et peut stimuler l’activité ectopique auriculaire, notamment au niveau des veines pulmonaires, dont l’équipe de M. Haïssaguerre a montré l’importance. Le prétraitement par l’énalapril permet de prévenir en partie ces modifications. Le rôle de l’angiotensine II dans la stimulation de l’apoptose (mort cellulaire) a été démontré dans l’insuffisance cardiaque expérimentale. L’apoptose survient 24 heures après le début de la stimulation et s’accompagne d’une augmentation du taux d’angiotensine tissulaire et de l’expression de la MAPK, bientôt suivis d’une fibrose interstitielle.
Autres effets des IEC et des ARAII dans la FA
Le blocage du SRA, en diminuant l’angiotensine II, réduit aussi la pression artérielle aortique. Il augmente la bradykinine qui stimule également la synthèse de l’oxyde nitrique (NO). À l’inverse, la FA réduit la synthèse et la libération du NO, ce qui contribue aux complications emboliques car le NO inhibe l’adhésion des plaquettes à la surface des vaisseaux. Les IEC ont aussi un effet sympatholytique, augmentent la sensibilité des barorécepteurs et agissent sur l’épargne potassique.
Données cliniques
De grands essais cliniques ont évalué les effets bénéfiques des IEC et sur les ARAII dans l’hypertension, la maladie coronaire et l’insuffisance cardiaque. Parmi les plus représentatifs, on citera les études :
• HOPE (Heart Outcomes Prevention Evaluation) menée avec le ramipril, un IEC,
• LIFE (Losartan Intervention For Endpoint reduction) menée avec le losartan, un ARAII, dans le traitement de l’hypertension artérielle,
• EUROPA (EUropean trial on Reduction Of cardiac events with Périndopril in stable coronary Artery disease) menée avec le périndopril (IEC) chez les coronariens stables.
Prévention du développement de la FA
Aucun grand essai n’a en revanche encore été publié étudiant l’effet de l’inhibition du SRA dans la prévention primaire de la FA. Nous disposons seulement d’analyses rétrospectives tirées des grands essais tel LIFE, qui a montré que le losartan entraîne une réduction de 49 % des AVC comparativement au groupe traité par l’aténolol chez les hypertendus avec FA et hypertrophie ventriculaire gauche (losartan 12 versus 21 % sous aténolol). La survenue de FA récente est de 8,2 % sous losartan et de 11,7 % sous aténolol.
Dans l’étude SOLVD (Studies Of Left Ventricular Dysfunction), 374 patients étaient en rythme sinusal sur le tracé ECG à l’inclusion. Après un suivi de 3 ans, 55 patients étaient en FA : 10 (5,4 %) sous énalapril et 45 (24 %) sous placebo, une différence hautement significative (p < 0,0001).
Dans l’étude TRACE (TRAndolapril Cardiac Evaluation Study), les patients avec un infarctus du myocarde aigu et une fraction d’éjection du ventricule gauche basse (< 36 %) ont été randomisés pour recevoir du trandolapril, un IEC ou un placebo. Sur les 1 577 patients au départ en rythme sinusal, 64 ont développé une FA au cours d’un suivi de 2 à 4 ans. Le trandolapril a réduit la survenue de la FA qui est de 5,3 % dans le groupe placebo et de 2,3 % dans le groupe trandolapril (p < 0,05).
Prévention des récidives de FA
Deux études prospectives ont porté sur la prévention des récidives de FA. L’étude de Madrid et al comprend 154 patients en FA persistante, randomisés en deux groupes, l’un recevant de l’amiodarone seule (400 mg par jour) et l’autre de l’amiodarone à la même posologie plus un ARAII, de l’irbésartan (150 mg par jour, et jusqu’à 300 mg par jour chez les hypertendus). Après un suivi de 12 mois, le nombre de récidives de FA a été réduit de 65 % dans le groupe associant amiodarone et irbésartan.
Une métaanalyse de 6 essais randomisés a montré que les IEC et les ARAII permettent de réduire le risque relatif d’apparition de la FA ou de sa récidive de 50 % en moyenne.
Une autre étude (Ueng et al) a comparé l’effet de l’énalapril (20 mg par jour) associé à de l’amiodarone (200 mg par jour), à de l’amiodarone seule, administrés un mois avant une cardioversion, sur les récidives de FA postcardioversion. Le suivi a montré que 74 % des patients du groupe associant l’énalapril et l’amiodarone étaient en rythme sinusal comparativement à 57 % des patients sous amiodarone seule.
Conclusions
Plusieurs analyses de grandes études sur l’hypertension artérielle, l’insuffisance cardiaque ou la maladie coronaire ont montré que les IEC ou les ARAII peuvent prévenir le développement de la FA et la survenue d’AVC.
Des études prospectives plus récentes mais sur un nombre limité de patients ont montré que le blocage du SRA par les IEC et les ARAII semble prévenir la survenue des récidives de FA postcardioversion.
Le mécanisme le plus probablement en cause concerne le remodelage électrique et structurel de l’oreillette, la formation de la fibrose et les effets sur le remplissage auriculaire et la tension sur la paroi ventriculaire.
D’autres études sont nécessaires avant de pouvoir recommander l’utilisation systématique des IEC/ARAII dans la prévention de la FA. Si elles sont positives, elles offriraient ainsi une nouvelle option thérapeutique dans le traitement de la FA.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :