Valvulopathies
Publié le 06 oct 2009Lecture 9 min
Traitement percutané du rétrécissement aortique calcifié - Différentes voies d'abord, avantages et inconvénients
P. NATAF, Service de chirurgie cardiaque, Hôpital Bichat, Paris
L’implantation par cathétérisme de bioprothèses aortiques, actuellement réservée à une population de malades à haut risque opératoire ou contre-indiqués à la chirurgie conventionnelle, est une technique en pleine évolution. Différentes voies d’abord ont été proposées. L’approche rétrograde par cathétérisme artériel fémoral et l’abord antérograde par ponction directe de l’apex cardiaque sont les deux techniques les plus fréquemment employées. Les risques de ces voies d’abord ne sont pas totalement connus et les avantages théoriques d’une technique par rapport à l’autre sont encore en discussion.
Chirurgie de remplacement valvulaire aortique par sternotomie et sous CEC
C’est le traitement de choix et de première intention du rétrécissement aortique calcifié.
Après aortotomie, les valves natives sont excisées et l’anneau aortique décalcifié. Une prothèse valvulaire biologique ou mécanique est ensuite suturée à l’anneau aortique pour remplacer la valve native. L’aortotomie est fermée et le cœur est sevré de la circulation extracorporelle (CEC).
Le remplacement valvulaire aortique par sternotomie est le traitement de référence pour le rétrécissement aortique calcifié. Ses résultats montrent une amélioration durable de la survie et de la qualité de vie. La mortalité à 30 jours d’un RVA isolé est de moins de 4 %. Certains facteurs peuvent cependant accroître le risque opératoire : l’urgence (x 10), l’insuffisance rénale (x 4,9), la classe NYHA III-IV versus I-II (x 3,1), les troubles neurologiques (x 4,3). Une analyse multivariée sur plus de 6 000 patients a montré que les 5 plus grands facteurs prédicteurs de mortalité après un RVA sont l’âge ≥ 80 ans, la classe NYHA ≥ III, la FE ≤ 30 % associée à un antécédent d’IDM, la chirurgie en urgence et un pontage coronaire associé au RVA (qui double le risque opératoire).
La gravité de certaines comorbidités, l’âge avancé et certaines particularités techniques (aorte « porcelaine », réinterventions multiples, séquelles sévères de radiothérapie, etc.) peuvent faire récuser la chirurgie. Dans ce cas, des alternatives peuvent être discutées.
La valvuloplastie au ballon décrite dans le années 1980 a été la première alternative à la chirurgie. Les resténoses très fréquentes ont fait que cette technique n’est utilisée que comme procédure palliative avant chirurgie ou implantation percutanée de bioprothèse.
L’implantation par voie transcathéter
L’implantation humaine d’une bioprothèse aortique par voie transcathéter (Transcatheter aortic valve implantation (TAVI)) a été réalisée pour la première fois en 2002 par Alain Cribier et son équipe. Il s’agit d’une approche évitant la sternotomie et ne nécessitant pas de CEC. Elle peut éventuellement être réalisée sous anesthésie locale. Initialement, la procédure a été réservée à des cas compassionnels contre-indiqués pour une chirurgie sous CEC.
Les valves
L’évolution technologique et la recherche pour la mise au point de ces prosthèses percutanées sont extrêmement rapides et de nouveaux produits sont actuellement en cours d’élaboration. Cependant, deux dispositifs « pionniers » sont actuellement commercialisés (figure 1). Leur principe repose sur une mise en place d’une prothèse autoexpansible ou déployée par inflation d’un ballonnet.
Figure 1. Les bioprothèses aortiques implantées par cathétérisme actuellement disponibles. À gauche, la valve Edwards SAPIEN® THV (Edwards Lifesciences) et à droite la valve CoreValve® (Medtronic. CoreValve Inc).
La prothèse Sapien-Edwards® (Edwards Lifesciences Inc, California, USA) est constituée de 3 feuillets en péricarde bovin montés sur un stent. La prothèse existe en 2 dimensions : 23 et 26 mm et est disponible pour une implantation par voie fémorale ou transapicale. Elle est montée sur un ballonnet dont l’inflation assure sa mise en place.
Le système CoreValve Medtronic® (Medtronic, Mineapolis, USA), est également constitué de 3 feuillets en péricarde bovin. La prothèse est montée sur un stent autoexpansible. Deux diamètres (26 et 29 mm) sont disponibles. Le système est utilisable pour une implantation rétrograde vasculaire.
Technologie d’implantation
L’implantation est réalisée sous contrôle radiologique et échographique, idéalement dans une salle d’opération équipée d’un système d’imagerie dite « salle hybride ». Quand une telle salle n’est pas disponible en raison de l’importance d’une imagerie d’excellente qualité, l’utilisation de la salle de cathétérisme peut être proposée. Une approche multidisciplinaire avec des équipes de chirurgiens cardiovasculaires, de cardiologues et d’anesthésistes est cruciale pour le succès de la procédure.
Un bilan pré-opératoire complet est réalisé. L’échographie transthoracique et transœsophagienne, la coronarographie, l’angiographie aortique et fémoro-iliaque et le scanner cardiaque et vasculaire servent, en plus de leur intérêt diagnostique, à évaluer les possibilités d’implantation et orientent sur le choix de la voie d’abord. La mesure du diamètre de l’anneau aortique, la distance entre l’anneau et les ostia coronaires, l’existence d’une bicuspidie, la présence d’un bourrelet septal, le diamètre des axes fémoro-iliaques et la qualité du lit vasculaire sont des éléments à prendre en considération pour juger du risque technique et de la faisabilité de l’implantation.
La voie rétrograde transfémorale
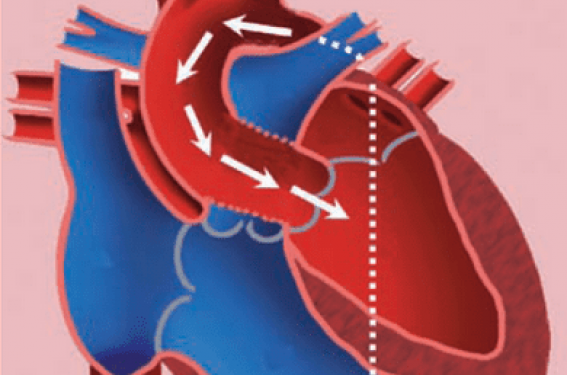
(figure 2)
Figure 2. L’approche rétrograde vers la valve aortique par cathétérisme artériel fémoral. L’inconvénient majeur de cette voie d’abord est le risque vasculaire.
Un abord chirurgical ou percutané de l’artère fémorale permet d’introduire le système qui va cheminer dans les axes iliaques puis dans l’aorte abdominale et thoracique. Le premier temps de l’implantation consiste en une dilatation de la valve aortique native suivi de la mise en place de la prothèse. Une stimulation ventriculaire rapide est effectuée lors du déploiement de la valve pour éviter toute mobilisation lors de son expansion. Un contrôle échographique et angiographique est réalisé en fin de procédure pour s’assurer d’un bon fonctionnement de la prothèse et de son bon positionnement avec absence de fuite paravalvulaire. Après retrait des cathéters, la réparation des vaisseaux fémoraux est effectuée. Des systèmes de fermeture artérielle peuvent permettre dans certains cas une approche purement percutanée. Plus rarement, en cas d’abord fémoro-iliaque contre-indiqué, une implantation par voie sous-clavière, voire rétropéritonéale, ont été proposées. Dans ces cas, la voie d’abord transapicale est le plus souvent indiquée.
La voie transapicale
(figure 3)
Figure 3. L’approche par voie transapicale permet une implantation antérograde directe et simple. Elle permet d’éviter les complications vasculaires majeures de la voie fémorale.
La technique consiste à aborder la pointe du cœur par une minithoracotomie antéro-latérale d’environ 5 cm dans le 5e ou 6e espace intercostal gauche. Un système de deux bourses circulaires renforcées par des attelles de téflon pour éviter la déchirure musculaire est mis en place. Une électrode de stimulation ventriculaire est fixée sur le myocarde par cette mini-incision. Elle permettra de réaliser une stimulation ventriculaire rapide lors de la dilatation au ballonnet de la valve aortique et lors de l’implantation du stent valvé. La ponction directe sous contrôle de la vue de la pointe du cœur par une aiguille de petit calibre permet l’introduction d’un guide qui va franchir par un trajet court, direct et dans le sens de la circulation sanguine la valve aortique. L’échographie transœsophagienne effectuée pendant la manipulation des cathéters permet de vérifier la direction du guide vers l’orifice aortique et prévient ainsi les fausses routes vers l’oreillette gauche avec le risque d’interférence avec l’appareil sous valvulaire mitral. La faible distance entre la pointe du cœur et l’anneau aortique a l’avantage d’offrir une précision dans le positionnement et une stabilité accrue lors du déploiement de la prothèse. Le risque neurologique et vasculaire est extrêmement réduit par ces manipulations essentiellement cardiaques.
Quelle voie d’abord privilégier ?
La voie d’abord fémorale semble a priori moins traumatisante et psychologiquement plus facilement acceptable chez des malades à fortes comorbidités qu’un abord cardiaque direct. Cependant, le cathétérisme rétrograde par un matériel de gros diamètre peut être source de complications vasculaires, hémorragiques et neurologiques majeures. Le franchissement d’artères fémorales et iliaques de petit calibre, tortueuses, calcifiées, athéromateuses et/ou sténosées, comme c’est fréquemment le cas chez les personnes âgées, peut s’avérer délétère. De même, l’athérome au niveau de l’aorte abdominale et thoracique peut être source d’embolie périphérique, de dissection ou de rupture de plaques. Le franchissement de la crosse aortique et les manipulations à ce niveau sont parfois responsables de complications neurologiques. Le franchissement de la valve aortique lors du cathétérisme rétrograde chez les patients porteurs de rétrécissement aortique calcifié est parfois difficile, long et risqué. Par ailleurs, la grande distance séparant l’artère fémorale de l’anneau aortique rend la précision et la technicité nécessaire pour l’implantation valvulaire délicate. La miniaturisation du matériel pourra, certes, lever certains écueils de cette technique mais n’éliminera cependant pas la complexité et le risque de la procédure. Plus récemment, un abord par l’artère sous-clavière a été proposé pour limiter en partie ces inconvénients.
L’approche par voie transapicale a l’intérêt d’être une technique d’implantation antérograde directe, simple et rapide. Elle évite les complications potentielles décrites pour la voie fémorale par l’absence de nécessité de parcourir, par voie rétrograde, l’ensemble du réseau artériel fémoro-iliaque et aortique du patient. L’inconvénient de cette voie d’abord est qu’elle doit être réalisée par une équipe médico-chirurgicale comportant des praticiens sachant faire une minithoracotomie et pouvant gérer une complication hémorragique liée à la ponction cardiaque.
Les contre-indications de la voie transapicale sont très rares. L’existence d’un thrombus apical, d’un antécédent de cure d’un anévrisme apical, d’une pneumonectomie gauche ou, encore plus exceptionnellement, de calcifications péricardiques majeures localisées à l’apex sont des obstacles d’ordre technique à l’implantation.
Les difficultés concernent en fait essentiellement l’état préopératoire du patient et ne sont en aucun cas liés à la technique d’implantation qui sera possible dans la très grande majorité des cas avec une implantation valvulaire pratiquement toujours réussie. Un patient grabataire, pour lequel l’espérance de vie est extrêmement réduite du fait de ses comorbidités, à faible potentiel de récupération postopératoire ne peut en aucun cas être un candidat à cette technique. La nécessité d’une anesthésie générale avec ventilation assistée peut également être un obstacle chez les patients insuffisants respiratoires sévères. Dans ces conditions, une implantation sous anesthésie locale par voie vasculaire est préférable en prenant toujours en compte l’intérêt du remplacement valvulaire aortique par rapport au traitement médical seul dans cette population.
Quels résultats des voies percutanées ?
Le registre Source portant sur environ 1 000 patients (tableau) montre des résultats en termes de succès d’implantation et de survie à 30 jours convenables dans cette population de patients à très haut risque chirurgical. Les complications vasculaires majeures sont l’inconvénient essentiel de la voie d’abord fémorale. La voie transapicale a été réservée aux patients au risque le plus élevé. L’idéal, pour bien évaluer les outils thérapeutiques que nous avons actuellement à notre disposition, serait de réaliser une étude randomisée comparant les deux voies d’abord, fémorale et apicale, pour des groupes comparables de patients.
Les résultats de l’étude Partner US randomisant à la fois l’approche percutanée comparativement au traitement chirurgical classique pour les patients à haut risque opératoire mais opérables, et le traitement percutanée par rapport au traitement médical seul pour les patients contre-indiqués pour la chirurgie apporteront probablement une partie des réponses attendues pour déterminer le réel intérêt de ces approches.
En pratique
Il est certain que la courbe d’apprentissage dans la pratique de la technique et surtout dans la sélection des indications va permettre d’améliorer les résultats immédiats et à distance de ces alternatives à la chirurgie. De même, l’évolution de la technologie visera à perfectionner à la fois les systèmes de cathétérisme et la prothèse valvulaire dont la durabilité devra être évaluée et confirmée avant d’étendre les indications d’implantation à des groupes de patients à plus faible risque opératoire.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :







