Polémique
Publié le 01 oct 2017Lecture 5 min
Ablation épicardique dans le Brugada - Une bonne piste thérapeutique ?
G. MASSOULIÉ, service de cardiologie, CHU de Bordeaux
La prise en charge du syndrome de Brugada implique une décision individualisée concernant le dépistage, la stratification du risque de mort subite et le traitement des arythmies ventriculaires. Ces décisions sont guidées par les connaissances de cette pathologie en constante évolution ces deux dernières décennies.
La stratification du risque rythmique repose sur la présence spontanée d’un aspect de type 1 de Brugada, sur la survenue de symptômes (syncopes nocturnes, mort subite récupérée), pour certains sur l’inductibilité d’une fibrillation ventriculaire (FV) lors d’une stimulation ventriculaire programmée ou encore sur l’existence de périodes réfractaires ventriculaires courtes. Selon le registre européen FINGER(1), les patients porteurs d’un Brugada de type 1 sont exposés à un risque d’arythmie ventriculaire de 0,5 %/an en l’absence de symptômes, et de 11 %/an en leur présence. La défibrillation automatique et la quinidine étaient jusqu’à présent les principales thérapies utilisées afin de traiter ces épisodes rythmiques.
Recommandations de prise en charge
L’implantation d’un défibrillateur automatique est recommandée par la Société européenne de cardiologie en cas de mort subite, d’arythmies ventriculaires documentées (I C) ou en présence d’un aspect de type 1 et de syncopes (IIa C). En cas d’arythmies ventriculaires récidivantes, la quinidine par voie orale ou l’isoprénaline par voie intraveineuse(2) réduisent efficacement le nombre d’épisodes et donc de défibrillations(3-5). Ces recommandations concernent une population de patients jeunes, exposés à des chocs électriques récidivants. En effet, en cas d’arythmie ventriculaire, 35 % des patients présentent une récidive rythmique à 4 ans, 44 % à 7 ans et 48 % à 10 ans(6-8). L’étroite fenêtre thérapeutique et des effets secondaires invalidants limitent l’utilisation de la quinidine. La perfusion d’isoprénaline est quant à elle une thérapie temporaire, s’intégrant dans le traitement en urgence de FV répétées. L’ablation par voie épicardique est une thérapie alternative ou adjuvante. Elle est recommandée en cas d’orage électrique ou de chocs électriques récidivants (recommandations européenne et nord-américaine, classe IIb C).
Ablation et syndrome de Brugada
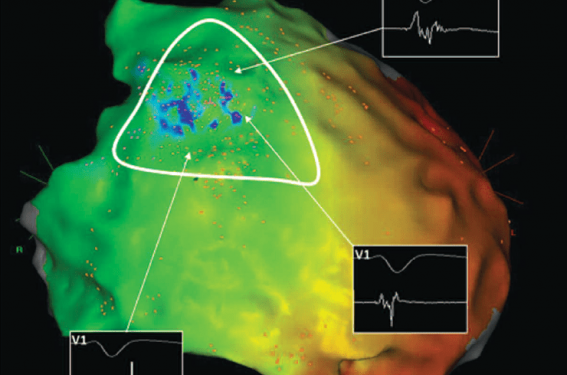
Initialement décrite en 2003 par voie endocardique(9), l’ablation des extrasystoles ventriculaires (ESV) initiatrices, proche de l’infundibulum pulmonaire (RVOT) réduit l’inductibilité et la récurrence de FV (suivi 7± 6 mois). Cependant identifier ces ESV initiatrices peut s’avérer difficile, car elles sont souvent fugaces. C’est presque 10 ans plus tard, que la présence d’un substrat arythmogène sur la face épicardique du RVOT a été décrite(10). Des signaux bipolaires de faible amplitude (< 1 mV), fragmentés et de durée prolongée (> 120 ms) correspondant à la composante terminale du QRS en V1-V2 tapissent le versant épicardique de l’infundibulum du ventricule droit (figure). Après leur ablation chez 9 patients (Brugada type 1) aux antécédents de FV récidivantes, 7 n’étaient plus inductibles. L’aspect de Brugada avait disparu dans les dérivations précordiales (8/9). Aucune récidive rythmique n’a été observée au cours des 20 mois de suivi.
Figure. Evolution de l’ECG avant (A) et après (B) ablation épicardique. Cartographie d’activation épicardique en vue antéropostérieure et délimitation de la zone d’intérêt en regard du RVOT (C). Détails des signaux bipolaires anormaux, fractionnés parfois tardifs et de faible amplitude (vitesse de défilement 100 mm/s) recueillis par un cathéter multipolaire (Pentaray®NAV, Biosense Webster) (C et D).
Une stratégie d’ablation guidée par le substrat facilite la prise en charge, notamment l’organisation de la procédure en l’absence d’enregistrement de l’ESV. Elle s’affranchit des limites de l’ablation d’une ESV initiatrice (identification pré-procédure, localisation per-procédure). Confirmant l’efficacité de cette approche, C. Pappone et J. Brugada et al., ont publié cette année la plus large série (n = 135) de patients explorés par voie épicardique(11). L’indication avait été retenue non seulement en cas d’antécédent de FV (63/135 patients dont 39 symptomatiques), mais aussi de FV induite (72/135). Un aspect de type 1 était spontané pour 31/135 patients. Comme souvent, une corrélation directe existait entre l’étendue du substrat épicardique et l’aspect de l’ECG 12 dérivations. L’ablation normalisait l’ECG de repos (> 90 %) et le test à l’ajmaline (60 %) et la récurrence de FV uniquement en présence des symptômes.
Technique de cartographie et d’ablation
L’abord du péricarde est classiquement sous-xiphoïdien à l’aide d’une aiguille de Tuohy (Tuohy bevel, 18 G, 1,3 x 150 mm ; B. Braun). Elle est guidée par la fluoroscopie (incidence latérale 90°). L’injection péricardique du produit de contraste puis l’insertion du guide confirme l’accès à l’espace péricardique(12). Une ponction antérieure et une gaine orientable facilitent la navigation dans l’espace péricardique. L’utilisation de cathéters multipolaires autorise une cartographie précise de la paroi antérieure et de la chambre de chasse du VD. Ils améliorent le recueil de signaux parfois difficiles à identifier. L’injection d’ajmaline IV augmente la sensibilité de cette cartographie en accentuant les anomalies du substrat(11,13). Le but de l’ablation est l’élimination totale des potentiels anormaux (haute fréquence, bas voltés). Un cathéter d’ablation irrigué est recommandé. Un contact suffisant (> 5 g) et une énergie de radiofréquence de 30 watts (45 watts pour certains) créent des lésions efficaces en 10 à 20 secondes. La durée moyenne de radiofréquence radiofréquence, dépendante de l’extension du substrat est inférieure à 30 minutes. La surface moyenne à traiter est proche de 20 cm2. Une fois les potentiels éliminés, une nouvelle cartographie s’assure de l’efficacité de la procédure tout comme un test d’inductibilité si celui-ci était positif en début d’intervention.
Faisabilité et complications
En cas de tachycardie ventriculaire, l’épicarde est accessible (> 90 %) par voie percutanée en l’absence d’antécédent de chirurgie cardiaque, de péricardite ou de patch de défibrillateur. Moins de 20 % des cas peuvent nécessiter un abord chirurgical (mini-thoracoscopie ou thoracotomie). Le taux de complications précoces ou tardif est proche de 7 %. Les centres expérimentés, de haut volume, revendiquent un taux de complications inférieur à 2 %(11,13). Au cours de la procédure, la survenue d’un épanchement péricardique > 80 cm3 est la principale complication (4,5 %). La ponction du ventricule droit (20 %) en est rarement la cause. Classiquement, un syndrome douloureux péricardique (35 à 100 %) marque les premiers jours postprocéduraux. À distance, une nouvelle procédure d’ablation doit être rediscutée face à une éventuelle récurrence d’arythmie ventriculaire.
Conclusion
Nous sommes convaincus du bénéfice de l’ablation épicardique des patients porteurs d’un syndrome de Brugada et victimes d’épisodes rythmiques récurrents. Son but est la disparition des épisodes de FV traités par un défibrillateur, plus rarement ou en cas d’urgence, le contrôle d’un orage rythmique réfractaire aux thérapies standards.
Elle n’est pas pour l’heure une alternative au défibrillateur.
Réalisée dans des centres avec un haut volume d’activité, le taux de complications est faible.
Les recommandations actuelles de prise en charge reposent sur des études prospectives, de cohorte. Des travaux randomisés, multicentriques permettront de confirmer son efficacité et de définir la meilleure stratégie de prise en charge des patients symptomatiques (Etude BRAVE, Clinicaltrials number : NCT02704416).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


