Technologies
Publié le 30 nov 2014Lecture 6 min
Défibrillateur entièrement sous-cutané - Performances et indications
H. BLANGY, L. FREYSZ, N. SADOUL, département de cardiologie, Institut des maladies du cœur et des vaisseaux Louis Mathieu CHU de Nancy
La défibrillation implantable semble avoir atteint une certaine maturité. Pourtant, la vie du patient implanté n’a rien d’un long fleuve tranquille, entre alertes de fiabilité, chocs inappropriés, ruptures de sondes et infections de matériel. Dans une certaine mesure, la face sombre du défibrillateur a pu conduire certains de nos confrères à hésiter à l’heure de nous confier un patient, particulièrement s’il est jeune et en prévention primaire. Ces « incidents » ne doivent pas faire oublier les bénéfices et le nombre de patients sauvés par la technique, certes imparfaite.
La sonde par sa technologie et son rôle central reste incontestablement le talon d’Achille du défibrillateur, d’où l’idée de développer un système muni d’une électrode entièrement sous-cutanée qui ne serait pas soumise aux mêmes contraintes physiques (100 000 contractions cardiaques par jour), donc éventuellement plus fiable à long terme et qui, si elle venait à s’infecter, n’exposerait pas le patient aux risques d’endocardite, de sepsis et d’extraction. Le S-ICD est né.
Caractéristiques techniques
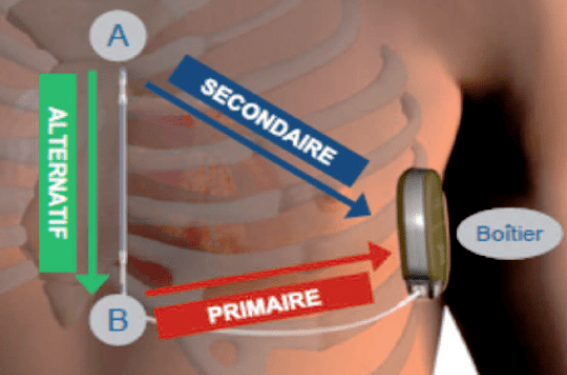
Le système a été développé par la société Cameron puis secondairement repris par Boston Scientific(1). Il associe un boîtier et une électrode entièrement sous-cutanée. Le volume du boîtier est de 70 cm3 pour une masse de 145 g (figure 1) lorsque nous sommes habitués à des défibrillateurs de 30 cm3 et 70 g. Cela dit, il intègre une batterie qui lui confère une espérance de vie de 5 ans et lui permet de délivrer des chocs de 10 à 80 J (maximum 5 x 80 J par épisode). Cet appareil n’est pas (encore) IRM compatible et il ne délivre pas d’ATP ni de stimulation. En revanche, il peut stimuler quelques secondes en postchoc par voie transthoracique. La détection est assurée par des électrodes de surface en 3 points définissant 3 vecteurs (figure 2).
Figure 1. Le S-ICD et sa sonde tripolaire.
Figure 2. Système de détection utilisant 3 électrodes de surface (A, B, boîtier) et 3 vecteurs.
Deux zones de détection sont programmables : une zone optionnelle de chocs conditionnels à partir de 170 batt/min et jusqu’à 240/min où il existe une discrimination du rythme, et une zone de chocs programmable au minimum à partir de 170/min et au maximum à partir de 250/min. La discrimination repose sur une analyse à la fois statique et dynamique de la morphologie, et sur la largeur du QRS.
La sonde est une sonde tripolaire de 9 F en polyuréthane munie d’un coïl de défibrillation.
Technique d’implantation
Un screening doit être absolument effectué avant l’implantation pour s’assurer que la détection sera correcte en obtenant un tracé de surface sur 3 dérivations reproduisant l’ECG vu par le S-ICD (figure 3). La technique d’implantation repose sur un abord exclusivement sous-cutané.
Une incision axillaire basse est réalisée pour placer le boîtier. Selon la corpulence du patient, celui-ci pourra rester sous-cutané ou être rétro-musculaire. Il doit être fixé dans la loge. La sonde est tunnélisée à partir d’une incision paraxiphoïdienne gauche vers le boîtier et le long du bord gauche du sternum. Boston Scientific recommande pour l’instant d’effectuer systématiquement un test de défibrillation à 65 J et de réaliser une épreuve d’effort à 1 mois.
Figure 3. Screening avec un ECG de surface sur 3 dérivations.
Cas clinique
Léa, 17 ans consulte pour un souffle cardiaque. Elle n’a pas d’antécédent de syncope, mais sa mère est décédée de mort subite lorsqu’elle avait 2 ans. La découverte d’une cardiomyopathie hypertrophique (CMH) avec un septum à 32 mm (figure 4) fait décider d’implanter un défibrillateur. Le choix se porte sur un S-ICD compte tenu de l’âge de la patiente. Il est placé en rétromusculaire dans la loge axillaire (figures 5 et 6).
Figure 4. Coupe parasternale gauche du VG de Léa.
Figure 5. Thorax de face postimplantation du S-ICD de Léa.
Figure 6. Cliché postopératoire, S-ICD en position rétromusculaire, 2 incisions.
Sécurité, efficacité
Environ 1 200 patients ont été inclus dans les différentes études publiées(2, 3). Les premiers travaux se sont attachés à démontrer la sécurité et l’efficacité du S-ICD. Lorsqu’il est comparé au défibrillateur conventionnel, le S-ICD est tout aussi efficace pour détecter et traiter un trouble du rythme ventriculaire rapide induit ou spontané (figure 7) et le taux de complications périprocédurales semble similaire, s’agissant essentiellement d’hématomes, infections locales et traitements inappropriés. En revanche, point de pneumothorax et peu de déplacements de sonde(3, 4). Dans EFFORTLESS S-ICD(3), le plus grand registre publié, le taux d’infections est de 4 %. Les auteurs soulignent que ce taux élevé reflète la faible expérience initiale des centres et que l’explantation n’est pas systématique (50 %). Bien sûr, les données à long terme manquent encore pour se faire une juste idée de la fiabilité du système. Les traitements inappropriés sont essentiellement dus à la surdétection de l’onde T ou à la qualité médiocre du signal alors qu’ils sont plus souvent provoqués par la FA avec un défibrillateur classique. Dans les différentes séries dont les suivis vont de 7 à 18 mois, le taux de chocs inappropriés est compris entre 4 et 25 %, le plus souvent autour de 14 %(2), c’est-à-dire assez proche de ce que l’on constate habituellement. Dans EFFORTLESS S-ICD(3), le taux annuel de chocs inappropriés est de 7 %. Les auteurs soulignent l’intérêt de programmer une zone conditionnelle jusqu’à des fréquences élevées (> 220/min). Pour Gold et al. qui ont comparé de façon prospective les performances des algorithmes du S-ICD et de 3 défibrillateurs double chambre classiques(5), la discrimination des TSV serait même meilleure avec un S-ICD.
Figure 7. Détection et traitement d’une FV.
À qui proposer un S-ICD ?
Le S-ICD fait pour la première fois son apparition dans les recommandations internationales, avec une recommandation de classe IIb en prévention de la mort subite dans la cardiomyopathie hypertrophique(6).
Certaines indications semblent évidentes compte tenu de la philosophie du S-ICD : canalopathies, CMH, mort subite sur cœur sain… D’autres situations sont clairement des contre-indications : patients avec indication de stimulation cardiaque, de CRT ou présentant des TV accessibles à l’ATP.
La question est plus difficile à trancher s’agissant du plus grand nombre, c’est-à-dire des indications de prévention primaire sur cardiomyopathie dilatée ou ischémique. On peut estimer à environ 20 % le nombre de patients en prévention primaire qui présenteront une TV sur 5 ans(7). Ce sont autant de patients qui pourraient bénéficier de la stimulation antitachycardique, indolore et efficace. De Bie et al.(8) ont voulu savoir combien de patients auraient pu recevoir un S-ICD dans une population de 1 345 patients implantés en prévention primaire ou secondaire, excluant ceux nécessitant un CRT ou une stimulation, suivis pendant 5 ans. Lorsque l’on retire les 34 % qui ont reçu un ATP, les 15 % qui ont eu besoin de stimulation, les 5 % qui sont passés au CRT, il reste 55 % de patients qui auraient pu avoir un SICD. Les auteurs identifient des facteurs prédictifs indépendants pour ne pas implanter un S-ICD (prévention secondaire, QRS large, NYHA III-IV). Alors faut-il privilégier le S-ICD en cas de prévention primaire avec QRS fins et NYHA I-II ? Oui répondront ceux qui souhaitent gagner du temps et épargner le capital veineux et les ruptures de sonde. Non diront ceux qui pensent aux 20 % de ces patients qui recevront un choc sur TV.
Les indications peuvent être résumées dans le tableau. Au final, le S-ICD en prévention primaire ne peut être proposé en première intention systématiquement. Il ne peut s’agir que de cas particuliers en présence d’un autre critère clinique (abord veineux difficile ou impossible, très jeune patient, infection, etc.). En revanche, le patient en attente de transplantation semble être un bon candidat.
Conclusion et perspectives
Le S-ICD est une alternative logique et originale au défibrillateur classique dans certaines situations cliniques bien délimitées. Il ne peut pour l’instant être généralisé à l’ensemble des indications de prévention primaire. La prochaine diminution de son volume devrait en améliorer l’acceptabilité chez les patients les plus maigres et les enfants.
Ses nombreux avantages en termes de limitation du risque d’infection et potentiellement de rupture de sonde en font un appareil d’avenir. L’arrivée du « leadless pacemaker » devrait à terme combler ses lacunes, en permettant par la combinaison des deux systèmes de délivrer de l’ATP et de stimuler les patients qui en ont besoin.
Le métier de stimuliste est en pleine mutation, les veines céphaliques vont retrouver leur quiétude.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


