Technologies
Publié le 29 oct 2024Lecture 6 min
Vers une électroporation de l’isthme mitral ?
Alexandre BODIN, CHRU de Tours
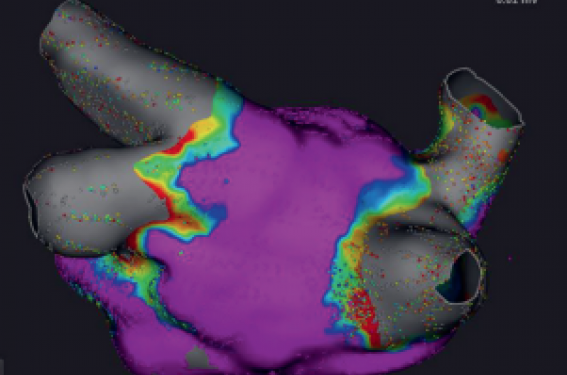
L’isthme mitral au niveau de l’oreillette gauche est considéré comme une structure stratégique dans la gestion des arythmies atriales comme le flutter atrial péri-mitral bien sûr(1), mais son blocage pourrait aussi apporter un bénéfice dans la fibrillation atriale persistante quand il s’intègre notamment dans le cadre du plan Marshall(2). Dans STAR-AF II, la stratégie de réaliser une ligne mitrale et au niveau du toit n’avait pas montré de différence significative comparée à la déconnexion des veines pulmonaires seules(3). Cette hétérogénéité de résultats pourrait en partie être expliquée par la complexité de l’anatomie de la région de l’isthme mitral, avec notamment des difficultés pour bloquer la ligne du fait de passages épicardiques, d’où l’intérêt potentiel de l’alcoolisation du Marshall mais aussi d’une ablation de la musculature du sinus coronaire(4).
L'électroporation est une énergie d’ablation non thermique. Le principe général est d’induire des pores sur les membranes cellulaires grâce à un champ magnétique puissant lui-même induit par des impulsions électriques ultra-rapides (microsecondes à nano - secondes). La création de ces pores sur la membrane (i.e., électroporation) induit à son tour un message de mort cellulaire(5). Il existe une spécificité cellulaire de la lésion induite du fait notamment des propriétés différentes des membranes cellulaires (cardiomyocytes, cellules nerveuses, cellules œsophagiennes…)(6). Le système Farapulse™ (Boston Scientific, Marlborough, Massachusetts, États-Unis), qui a obtenu son marquage CE en 2021, permet l’application d’électroporation initialement pour la déconnexion des veines pulmonaires et a prouvé son efficacité pour la prise en charge de la fibrillation atriale(7-9). L’avantage de cette technologie est sa sécurité avec notamment l’absence de lésion œsophagienne, de sténose pulmonaire ou de paralysie phrénique durable comme montré dans l’étude MANIFEST-17k incluant, comme son nom l’indique, 17 000 malades(10).
Nous décrivons dans cet article un cas clinique où nous avons finalement réalisé une ablation de l’isthme mitral par méthode d’électroporation avec le système Farapulse™.
Cas clinique
Un homme de 62 ans, triathlète, a pour principaux antécédents l’ablation à 2 reprises de l’isthme cavo-tricuspide pour un flutter atrial commun avec des collègues d’un autre centre en quelques mois. Il nous est adressé car il persiste des palpitations au pic de l’effort dans les mois qui suivent cette ablation et qu’il a été enregistré une fibrillation atriale paroxystique malgré un traitement par flécaïnide 200 mg LP. Les bêtabloquants ne sont pas supportés. Il n’a pas de facteurs de risque cardiovasculaires ni d’autres antécédents significatifs, son score de CHA2DS2-VASc est à 0. Au vu des données récentes et après discussion avec le patient, nous programmons donc une déconnexion des veines pulmonaires par électroporation sous anesthésie générale. Le scanner préopératoire met en évidence une anatomie favorable avec 4 veines pulmonaires et un volume atrial aux alentours de 220 mL.
La procédure se déroule initialement simplement. Le patient arrive en salle en rythme sinusal, anesthésie générale, ponction veineuse fémorale unique, mise en place d’une préfermeture médiée par une suture (Perclose Proglide™, Abbott, North Chicago, Illinois, États-Unis), abord transseptal guidé par ETO avec la gaine Faradrive™ et déconnexion séquentielle des veines pulmonaires (configuration standard, 4 applications en « fleur » et 4 applications en « basket » par veines). Pendant la déconnexion des veines pulmonaires droites, le patient passe en flutter atrial. Nous finissons la déconnexion des 4 veines pulmonaires et ce dernier persiste.
Nous réalisons donc un deuxième abord veineux avec mise en place d’une sonde décapolaire dans le sinus coronaire qui mettra en évidence une activation atriale par le sinus coronaire proximal vers le sinus coronaire distal. Les PPI (post-pacing-intervals) sont en faveur d’un flutter gauche possiblement périmitral. Nous décidons donc de basculer vers le système de cartographie Rhythmia™ et un cathéter multiélectrodes IntellaMap Orion™ (Boston Scientific, Marlborough, Massachusetts, États-Unis). Nous confirmons, grâce à la carte d’activation, un flutter atrial périmitral sur une oreillette saine en voltage bien que dilatée (220 mL) (figure 1). Les veines pulmonaires sont par ailleurs bien déconnectées.
Figure 1. Flutter atrial périmitral. Panel A : carte d’activation confirmant le flutter péri-mitral avec toutes les couleurs bien visualisées autour de l’anneau mitral. Panel B : carte de voltage mettant en évidence une oreillette par ailleurs saine.
Nous décidons donc de réaliser une ablation de l’isthme mitral et au vu de la dilatation atriale, une isolation du mur postérieur. Après administration de 2 mg de dinitrate d’isosorbide, nous obtenons un retour en rythme sinusal dès la première application en « fleur » dans la zone (figure 2). Cependant et comme discuté après, afin de tenter d’avoir une lésion la plus durable possible, nous allons consolider en réalisant au total 4 applications en « fleur » avec une rotation dans la partie la plus ventriculaire de l’isthme grâce au guidage par la cartographie, puis la même séquence un peu plus vers la veine. Nous réalisons enfin 4 applications en configuration « oursin », c’est-à-dire entre la position « fleur » et la position « basket ». Nous réalisons ensuite la déconnexion du mur postérieur en configuration « fleur » avec 18 applications et après 10 minutes d’attente, nous recontrôlons la carte et les blocs qui sont bien présents et bidirectionnels.
Figure 2. Application d’électroporation au niveau de l’isthme mitral. Retour en rythme sinusal dès la première application.
L’ICT était toujours bloqué des procédures précédentes.
Les suites sont simples sans complications ni douleurs postopératoires. Sur un suivi d’un an, il n’y a pas eu de récidive après l’arrêt des traitements à 3 mois post-intervention (anticoagulants et antiarythmiques).
Discussion
L’obtention d’un bloc de l’isthme mitral à l’aide de l’électroporation est aisée à la phase aiguë(11). Les reconnexions, même pendant la procédure, sembleraient en revanche fréquentes dans notre expérience et dans la littérature(11). En effet en électroporation, il existe un phénomène de lésion irréversible mais aussi de sidération autour de la zone de lésion, il faut donc en théorie multiplier les applications dans les zones plus épaisses et attendre avant de valider le bloc bidirectionnel.
La complication principale de l’électroporation au niveau de l’isthme mitral est le spasme coronaire de la circonflexe qui est juste à côté de la zone. Sa fréquence est encore mal évaluée mais il semble réversible et non risqué pour le patient(11,12). Afin d’éviter cette complication, 2 mg de dinitrate d’isosorbide (Risordan®) ont été administrés au patient avant l’application de l’électroporation. Aucune modification ECG ni aucun symptôme n’ont été constatés.
Une autre complication doit être surveillée : il s’agit de l’hémolyse qui peut conduire à une insuffisance rénale aiguë dans 0,03 % des cas10. Il suffirait d’hydrater les patients après un nombre d’applications important et de surveiller la fonction rénale après l’intervention, particulièrement si un grand nombre d’applications a été réalisé. Le seuil semble être à plus de 70 applications(13). Dans notre cas, malgré une ablation extensive, nous avons réalisé 67 applications, et finalement moins que ce nombre d’application « seuil » de l’hémolyse. Ceci est possiblement explicable par l’utilisation du système de cartographie pour guider notre geste.
La dernière question est celle du coût. En effet, actuellement, l’utilisation d’un système Farapulse™ couplé à un Orion™ est chère. Des solutions avec un mapping grâce au système Farapulse™ à l’avenir pourrait permettre de réduire ces coûts…
Figure 3. Résultat après l’ablation. Plus de signaux dans l’isthme mitral (panel A) et le mur postérieur (panel B).
CONCLUSION
• L’ablation de l’isthme mitral est réalisable simplement. La question centrale de cette approche reste la durabilité des lésions effectuées. L’utilisation d’un système de cartographie pourrait accroître la durabilité des lésions sans multiplier des applications inutiles. La réalisation d’une ligne inféro-latérale ainsi que la préadministration de dérivés nitrés pourraient optimiser la sécurité. Des études de plus grande ampleur sont donc nécessaires.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


