Focus
Publié le 20 déc 2019Lecture 11 min
Angioplastie coronaire assistée par robot : mythe ou réalité ?
Eric DURANDa, Rémi SABATIERb, Bruno FARAHc, Jean FAJADETc, a. CHU de Rouen, INSERM U1096, Rouen, b. CHU de Caen, Caen, c. Clinique Pasteur, Toulouse
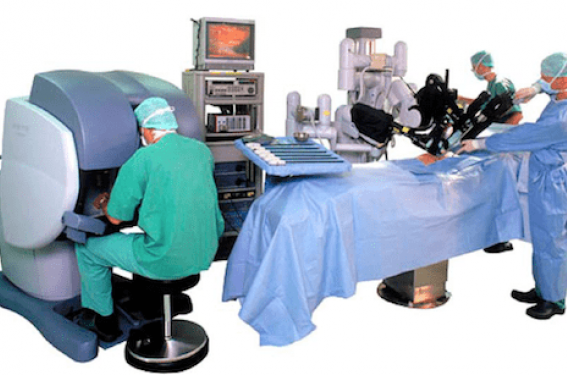
La robotique occupe une place croissante en médecine. Son application a débuté en chirurgie dans les années 2000. L’urologie a rapidement fait bénéficier les patients de ce progrès technologique, notamment lors des prostatectomies chez les patients atteints de cancer(1). Aujourd’hui, presque toutes les disciplines chirurgicales utilisent la robotique en pratique courante comme la gynécologie, la chirurgie thoracique et cardiaque, la chirurgie digestive ou encore ORL. En 2011, la robotique a fait également son apparition en angioplastie coronaire dans le but de réduire, d’une part, l’exposition aux rayons X des opérateurs et, d’autre part, les lésions musculosquelettiques induites par le port d’un tablier plombé.
La société Corindus (Waltham, États-Unis) a été la première à développer et commercialiser un système permettant de réaliser une angioplastie coronaire assistée par un robot. La faisabilité et la sécurité d’une angioplastie assistée par robot a été démontré dans des lésions simples puis complexes et, plus récemment, lors de procédures réalisées à distance(2-4). En France, la société Robocath (Rouen) a développé une première génération de robots (R-One™) permettant également de réaliser des angioplasties coronaires. Le 24 septembre 2019, les deux premières procédures ont été réalisées avec succès chez l’homme au CHU de Rouen (Prs E. Durand et R. Sabatier) et à la clinique Pasteur à Toulouse (Drs J. Fajadet et B. Farah).
Principe, impact et formation à la robotisation en chirurgie
Le terme « robot » dérive du tchèque robota, qui veut dire « travail, corvée ». Il a été utilisé pour la première fois en 1921 dans une pièce de Karel Capek où un savant avait créé un humanoïde capable d’accomplir tous les travaux d’un homme(5). Le terme est dorénavant consacré pour le « robot » chirurgical bien qu’il ne soit pas tout à fait adapté dans la mesure où ce dernier n’a pas d’autonomie.
L’interface informatique filtre les mouvements, fait disparaître le tremblement physiologique et permet une démultiplication du geste adaptée au grossissement de l’image avec une précision extrême(5). Le double système optique relié à deux caméras apporte une vision endoscopique en 3D et haute définition. La caméra est portée par un bras du robot, ce qui assure une stabilité de l’image. L’agrandissement de l’image est contrôlé par le chirurgien. Les instruments sont améliorés par rapport à ceux de la coelioscopie classique, essentiellement grâce à une articulation supplémentaire endocorporelle, ce qui rétablit les 7 degrés de liberté du membre supérieur. La position du chirurgien est nettement améliorée sur le plan ergonomique, puisqu’il travaille assis, les avant-bras sur des appuiebras ; son regard plonge dans l’image, ses mains en contrebas, rétablissant un axe yeux-mains perdu en chirurgie laparoscopique (figure 1). Le robot apporte des avantages visibles au patient que sont les petites cicatrices ; l’absence de différence extérieure postopératoire par rapport à la coeliochirurgie classique explique probablement grand nombre de critiques vis-à-vis de la chirurgie robotique dont le coût paraît alors prohibitif.
Figure 1. Robot chirurgical.
Les apports
Le robot apporte surtout des avantages invisibles mais perçus par le chirurgien et à qui ils paraissent évidents comme la qualité de dissection ou de suture, le transfert direct de la technique ouverte une fois la machine maîtrisée, des actes complexes rendus possibles et l’absence de fatigue. Tous avantages indirects pour le patient, mais difficilement quantifiables, qui permettent de repousser très largement les limites de la cœlioscopie. Cependant, des études randomisées ont permis d’établir des avantages significatifs (cosmétique, douleurs, durée d’hospitalisation, reprise d’une activité normale) pour le patient en comparaison avec la chirurgie laparoscopique standard(1).
La cible initiale visée par la société Intuitive Surgical® (Sunnyvale, États-Unis) lors de l’introduction du robot Da Vinci sur le marché mondial était la chirurgie cardiaque et en particulier les pontages coronariens(5). Les faits ont rapidement montré que la première spécialité à en bénéficier était l’urologie, notamment les prostatectomies pour cancer. Jusque 2007, la très grande majorité des interventions réalisées au robot étaient urologiques, mais depuis, d’autres spécialités se sont appropriées la chirurgie robotique notamment la chirurgie gynécologique (hystérectomie totale pour cancer, myomectomies, etc.). D’autres spécialités comme la chirurgie digestive, thoracique, pédiatrique ont adopté la technique.
Alors qu’en chirurgie ouverte puis en coelioscopie l’apprentissage se faisait par compagnonnage, avec une acquisition des différentes habiletés au contact d’un senior, la chirurgie robotique impose un éloignement entre le chirurgien et son aide et l’acquisition d’habiletés techniques très spécifiques(5).
Les étapes de la formation
Elles se font généralement en 3 phases :
Phase 1 : formation aux habilités de base par simulateurs de chirurgie robotique.
Phase 2 : apprentissage des procédures chirurgicales, spécifique de chaque spécialité et de chaque intervention. Cette formation fait appel également à la simulation, avec des exercices simulant des actes techniques particuliers de chaque procédure, et de plus en plus des interventions virtuelles. L’entraînement sur modèles inanimés est également proposé, ainsi que de la chirurgie sur animal ou sur cadavre.
Phase 3 : la dernière phase est appelée formation aux compétences non techniques et consiste en l’apprentissage au travail d’équipe que sont la cognition (prise de décision et conscience de la situation), les interactions sociales (communication, coopération) et les facteurs personnels (leadership).
Concept et résultat de l'angioplastie coronaire assistée par robot
Corindus Vascular Robotic (Waltham, États-Unis) est la première société à avoir développé et commercialisé un robot permettant de réaliser une angioplastie coronaire aux États-Unis. Cette société a par ailleurs été très récemment rachetée par Siemens pour un montant de 1,1 milliard de dollars.
Le robot est constitué d’un bras articulé habituellement fixé sur la table d’examen relié à la sonde d’approche, d’une cassette stérile permettant de commander les mouvements des guides d’angioplastie ainsi que les cathéters à ballonnet et les stents, et d’un pupitre plombé derrière lequel le médecin est assis et protégé des rayons X. Ce pupitre est composé d’un joystick pour manipuler le guide (translation, rotation) et d’un joystick pour manipuler le ballon ou le stent (translation). Le robot de deuxième génération permet également de manipuler la sonde d’approche par un troisième joystick dédié (figure 2).
Figure 2. Robot pour angioplastie coronaire développé par Corindus Vascular Robotic.
L’angioplastie coronaire robotisée a été développée afin de réduire, d’une part, l’exposition aux rayons X des opérateurs et, d’autre part, les lésions musculosquelettiques induites par la station debout prolongée et le port d’un tablier plombé. Comme pour la chirurgie robotique, l’opérateur travaille plus confortablement en position assise et manipule guides et cathéters à l’aide des joysticks à distance du patient depuis un pupitre protégé des rayons X par des vitres plombées transparentes sans la nécessité de porter un tablier de radioprotection. L’opérateur visionne la procédure sur un écran localisé au niveau du pupitre permettant de visualiser la procédure et surveiller l’ECG et l’hémodynamique (figure 2).
Comme pour la chirurgie robotique, l’intuitivité des mouvements reproduisant la gestuelle classique, l’absence de tremblement physiologique et la manipulation simultanée des guides et cathéter apportent une précision importante au geste. Contrairement à la chirurgie robotique, la courbe d’apprentissage est extrêmement rapide notamment chez des opérateurs expérimentés. Après un first-in-man incluant 8 patients, la première étude évaluant la faisabilité et la sécurité de l’angioplastie a été rapportée aux États-Unis en 2013(2,6).
PRECISE
Cette étude (Percutaneous Robotically-Enhanced Coronary Intervention) a inclus 164 patients aux États-Unis présentant des lésions simples, monotronculaires, dont le diamètre de référence était compris entre 2,5 et 4 mm et dont la longueur était inférieure à 24 mm et pouvant être traitées par un seul stent. Les lésions complexes (tronc commun, bifurcation, siège ostial, calcification, présence de thrombus, etc.) étaient exclues de cette étude. Les procédures étaient réalisées par le système CorPath 200 de première génération (sans joystick dédié pour la manipulation du cathéter guide) de Corindus.
Les principaux critères de jugement étaient :
– une sténose < 30 % en fin de procédure sans MACE ;
– sans conversion manuelle.
Les procédures ont été toutes réalisées par voie fémorale, le plus souvent en 6 F. La procédure a été jugée comme un succès dans 98,8 % des cas sans conversion manuelle(6). Aucune complication majeure relative à l’utilisation du robot n’a été rapportée et une réduction d’environ 95 % d’exposition des opérateurs aux rayons X était évoquée.
CORA-PCI
Plus récemment en 2017, l’étude CORA-PCI (Complex Robotically Assisted Percutaneous Coronary Intervention) a été publiée(3). Tous les patients consécutifs traités par angioplastie coronaire par assistance robotisée (n = 108) ou réalisées manuellement (n = 226) pour des lésions plus complexes (environ 2/3 de lésions type B2 ou C) ont été inclus. Les patients du bras robotique avaient un score Syntax moyen d’environ 19 et les procédures étaient réalisées par le système CorPath 200 de première génération. Un succès a été obtenu dans près de 99 % dans les deux types de procédures. Dans le bras robotisé, une assistance manuelle partielle était cependant nécessaire dans environ 10 % des cas et une conversion manuelle dans 7 % des cas. Le nombre de stents par procédure ainsi que la durée de scopie et le volume de contraste utilisé étaient similaires dans les deux groupes. En revanche, la durée de la procédure était un peu plus longue dans le bras robotisé(3).
Compte tenu de l’impossibilité de manipuler le cathéter guide par le système robotique avec le modèle de première génération nécessitant dans près de 10 % des cas une assistance manuelle, un modèle de seconde génération a été commercialisé (CorPath GRX). Il n’y a à ce jour aucune étude randomisée publiée comparant l’angioplastie coronaire réalisée manuellement ou assistée par la robotique. Toutes ces études ont été réalisées avec le pupitre placé à proximité immédiate du patient dans la salle de cathétérisme. En revanche, des études récentes ont par ailleurs démontré la faisabilité de réaliser une angioplastie coronaire dans un lieu proche de la salle de cathétérisme ou à très longue distance du site où est traité le patient, offrant des perspectives de traitement dans des zones géographiques dépourvues d’accès au cathétérisme(4, 7). Il faut cependant noter le coût important de l’angioplastie robotisée car le prix catalogue d’un robot de dernière génération CorPath GRX est d’environ 800 000 dollars et nécessite des consommables (cassettes stériles) d’environ 900 dollars par patient. Son homologue français, R-One™, présente un prix quasi similaire mais l’entreprise propose des consommables à un prix 3 fois inférieur.
Un robot français, R-OneTM, commercialisé par Robocath
Depuis plusieurs années, une société rouennaise, Robocath, a mis au point un robot (R-One™) permettant également de réaliser des angioplasties coronaires robotisées. Il est également composé d’une unité robotique portée par un bras support articulé sur le rail de la table d’examen, de cassettes stériles et d’une station de contrôle radioprotégée permettant de manipuler via des joysticks les mouvements du guide (translation, rotation) et des cathéters (ballon et stents, translation) (figure 3). L’installation de la cassette est très rapide et son utilisation très simple. Après avoir étudié la faisabilité et la sécurité du dispositif sur fantôme et chez l’animal, et obtenu le marquage CE en 2019, les deux premières procédures ont été réalisées avec succès chez l’homme au CHU de Rouen et à la clinique Pasteur le 24 septembre 2019.
Figure 3. Robot pour angioplastie coronaire développé par Robocath.
Dans la pratique
Le patient traité au CHU de Rouen (Prs Durand et Sabatier) était un patient de 57 ans aux antécédents de cardiopathie ischémique. Il avait été admis pour un SCA ST+ lié à une thrombose tardive d’un stent sur l’IVA moyenne traitée par une nouvelle angioplastie avec un excellent résultat. La coronarographie avait par ailleurs retrouvé une sténose significative longue de la première marginale en position bissectrice (figure 4). Cette dernière lésion a été traitée à l’aide du robot.
A
Avant angioplastie
Après angioplastie
B
Avant angioplastie
Après angioplastie
Figure 4. Angiographies coronaires avant et après angioplastie sur une lésion de l’artère bissectrice (A) et de la 2e marginale (B).
Par voie radiale, un guide SION Blue (Asahi Intecc) a été manipulé via le joystick dédié, a franchi aisément la lésion et a été positionné en distalité. Une prédilatation a été ensuite réalisée avec un ballon semi-compliant manipulé à l’aide du 2e joystick et a été aisément positionné au niveau de la lésion (Ryujin™ Plus 2,0 x 30 mm, Terumo). Enfin, à l’aide du même joystick, une endoprothèse active (Resolute Onyx™ 2,5 x 34 mm, Medtronic) a été positionnée aisément au niveau de la lésion. Après une inflation à 12 atm, le résultat final était satisfaisant avec un stent bien déployé sans sténose résiduelle (figure 4A). La procédure a nécessité l’injection de 90 cc de produit de contraste avec un temps de scopie de 6,89 min (air kerma 443 mGy).
Le patient traité à la clinique Pasteur (Drs Fajadet et Farah) était âgé de 69 ans avec des antécédents d’angioplastie avec stent actif sur l’IVA en 2007. Il avait été admis pour un angor de repos. La coronarographie a révélé une sténose serrée longue de la 2e marginale. La procédure a été réalisée à l’aide du robot par voie radiale en 6 F. Un guide BMW (Abbott) a été manipulé via le joystick dédié, a franchi aisément la lésion et a été positionné en distalité. Une prédilatation a été ensuite réalisée avec un ballon semi-compliant (2,5 x 20 mm) manipulé à l’aide du 2e joystick et a été aisément positionné au niveau de la lésion. À l’aide du même joystick, deux endoprothèses actives jointives (Synergy™ 2,75 x 28 et 2,5 x 28 mm, Boston) ont été positionnés aisément au niveau de la lésion. Après une postdilatation (Ballon NC 2,75 x 30 mm), le résultat final était satisfaisant avec un stent bien déployé sans sténose résiduelle (figure 4B).
Ces deux procédures précèdent la première étude clinique de ce type conduite en Europe. Elle implique six centres européens, dont trois en France (CHU de Rouen, CHU de Caen, Clinique Pasteur de Toulouse). Elle portera sur 60 patients et vise à démontrer la sécurité et l’efficacité de la plateforme d’assistance robotique R-One™ lors d’une angioplastie coronaire.
Perspectives
Les perspectives de la robotique dans le domaine de la cardiologie interventionnelle sont immenses. Les robots actuels permettent déjà de réaliser avec sécurité des angioplasties coronaires de plus en plus complexes. Les robots futurs permettront sans doute de repousser encore les limites de cette technologie. Le premier objectif est atteint avec une irradiation proche de 0 pour le praticien. Par ailleurs, nous travaillons avec une plus grande précision : nous avons une mesure plus fine de la lésion coronaire vers laquelle le robot permet d’avancer millimètre par millimètre de façon sécuritaire. La possibilité de réaliser des procédures à distance élargit encore plus le champ d’activité de la robotique. L’extension à d’autres activités vasculaire (périphérique, neurologie) se fera sans doute dans un avenir très proche.
Conclusion
L’angioplastie coronaire assistée par robot est une innovation récente en cardiologie interventionnelle et nous sommes probablement à l’aube d’une révolution importante dans la prise en charge de nos patients.
La dynamique de la robotique vasculaire est enclenchée. Les patients sont enthousiastes et les médecins l’adopteront pour réduire les expositions aux rayons et les pathologies dorsolombaires.
Conflits d’intérêt
Eric Durand, Rémi Sabatier et Jean Fajadet sont consultants pour la société Robocath.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


