Technologies
Publié le 30 sep 2014Lecture 8 min
CTO et approche hybride : intérêt
B. FAURIE, Groupe Hospitalier Mutualiste de Grenoble
Les procédures sur les occlusions coronaires chroniques (CTO) restent complexes avec des taux d’échec nettement supérieurs à l’angioplastie conventionnelle ce qui conduit à un très net « sous-traitement » de ces lésions. De plus, elles peuvent entraîner une morbidité spécifique aux procédures longues telles que la sur-irradiation et la néphrotoxicité liées aux produits de contraste.
Définition de l’approche hybride
L’approche nord-américaine baptisée « hybride » a été développée par un noyau de pionniers, Bill Lombardi, Craig Thompson ou Mike Wyman(1), sur une population avec un indice de masse corporelle (IMC) plus élevé qu’en Europe ou au Japon (où la CTO a été inventée) avec une attention particulière à la balance bénéfice risque de la procédure (figure 1). Ces deux facteurs les ont conduits à développer des techniques et des algorithmes afin de raccourcir les procédures de CTO tout en maintenant, voire même en augmentant, la sécurité et l’efficacité. Ainsi, la philosophie consiste à franchir la zone d’occlusion le plus rapidement possible pour limiter l’irradiation et le contraste et pouvoir changer de technique en cas d’échec.
Figure 1. L’approche hybride.
Pas de dogme, mais de multiples possibilités
L’approche hybride est basée sur une utilisation de toutes les techniques connues pour traiter les CTO. Elles sont utilisées par voie antérograde ou rétrograde indifféremment, et de façon intraluminale de « vraie à vraie » lumière ou encore en utilisant l’espace sous-intimal pour rejoindre la vraie lumière par « réentrée ». Cette démystification de l’espace sous-intimal est un point clé de cette approche. En termes d’efficacité, elle est rapide, sûre et conduit à de bons résultats à long terme. Bien entendu, un minimum de matériel adapté est nécessaire : guides en boucle, cathéter Cross- Boss™ et système de réentrée StinGray™ (figure 2).
Figure 2. Cathéter CrossBoss™ et système de réentrée StingRay™.
C’est l’anatomie qui guide la stratégie
Attention ! L’anatomie guide la stratégie de recanalisation de la CTO, mais l’indication de revascularisation, elle, est guidée par l’ischémie et ou la viabilité. Le mode de revascularisation, qu’il soit chirurgical ou percutané, est guidé par l’étendue des lésions, c’est-à-dire par les scores Syntax et Syntax II, conforté par une discussion médicochirurgicale en cas d’atteinte pluritronculaire. Finalement, l’occlusion chronique est l’archétype de la maladie coronaire stable sévère en termes de gestion médicale. Ensuite, grâce à 4 questions simples qui analysent l’anatomie de la CTO(2), on peut construire un algorithme (figure 3) qui va définir les techniques les plus efficientes, les classer dans le but de réussir la procédure de la manière la plus efficace. Cet algorithme a été construit par ce même groupe de cardiologues interventionnels passionnés qui ont analysé les films et les vidéos de dizaines de cas cliniques afin d’établir une corrélation entre anatomie et technique avec l’objectif de maximiser la sécurité et le succès.
Figure 3. Algorithme permettant l’analyse de l’anatomie de la CTO et faciliter la procédure (d’après Morino et al. JACC CI 2011 ; 4 : 213-21).
Les 4 questions clés
Tout l’algorithme est basé sur une description fine de l’anatomie de la CTO obtenue grâce à l’injection bilatérale simultanée à l’aide de 2 cathéters. Il s’agit d’ailleurs de cathéters d’angioplastie, ce qui rend plus facile le passage d’une technique antérograde vers une technique rétrograde ou inversement.
La chape proximale est-elle bien définie ? Comprend-on bien l’anatomie de la zone proximale de l’occlusion, sa localisation, son aspect (effilé ou émoussé) ou bien existe-t-il une ambiguïté anatomique qui peut gêner un abord antérograde?
Quelle est la longueur de la lésion ? La valeur seuil de 20 mm est communément admise.
Y a-t-il des branches collatérales et quelle est la qualité de la zone « d’atterrissage » du vaisseau cible en distalité de la CTO ?
Existe-t-il des collatérales interventionnelles ? C’est-à-dire des collatérales propices à une approche rétrograde.
Que dit la littérature ?
Les données quant à la sécurité et l’efficacité de cette approche ont été publiées dans de nombreux articles, dont l’article princeps paru en 2012 dans Catheterization(3) et basé sur l’expérience préliminaire. Le registre FAST-CTO publié en 2012 a évalué sur plus d’une centaine de cas les nouveaux systèmes Bridgepoint™ utilisant les cathéters CrossBoss™ et StinGray™(4). L’efficacité était satisfaisante avec un taux de succès de 87 %. En revanche, il y a eu un taux de tamponnade de 9 % par perforation des petites branches par le CrossBoss™. Ce problème a été rapidement résolu avec la courbe d’apprentissage du matériel et ne concernait que le premier tertile de l’étude.
En 2014, l’algorithme hybride utilisé sur plusieurs centaines de cas(5) a été validé. La sécurité et surtout l’efficacité de la technique avec des taux de complication bas et un taux de succès élevé, même supérieur à celui décrit dans les registres anglais et japonais, ont été confirmées.
Actuellement, le registre européen RECHARGE(6) collecte les données techniques. Les résultats de cette approche effectuée sur une dizaine de centres européens, dont trois français, a pour but d’obtenir des données sur 1 000 patients qui permettront de confirmer l’intérêt, la sécurité et l’efficacité de cette approche sur une large population non sélectionnée.
Les résultats préliminaires montrent que la première approche choisie est l’antérograde avec escalade des guides, que le matériel CrossBoss™ et/ou StingRay™ est utilisé dans 17 % pour des cas de difficulté intermédiaire (J-CTO entre 0 et 2) mais dans presque 30 % des cas difficiles (J-CTO > 3) (figure 4). Le taux de succès global sur 130 patients a été supérieur à 85 %.
Figure 4. Succès en fonction du score de difficulté (d’après Morino et al. JACC CI 2011 ; 4 : 213-21).
Cas clinique
Réalisé avec E. Bressollette aux Nouvelles Cliniques Nantaises
M. N. est âgé de 74 ans, est hypertendu et tabagique sevré. Il a une cardiopathie ischémique connue depuis 1990 traitée médicalement. La scintigraphie retrouve une myocardite systémique avec une large ischémie antéro-apicale d’effort réversible.
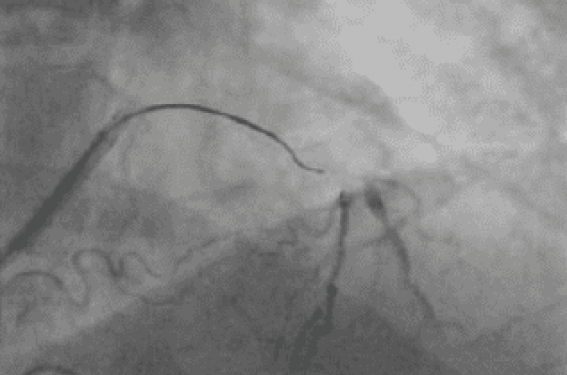
La coronarographie retrouve une atteinte monotronculaire avec une occlusion chronique de l’IVA (photo 1) après la naissance de la première diagonale et de la première septale. L’occlusion mesure 20 mm environ, la chape proximale est bien définie, il existe une sténose avant l’occlusion qui n’est pas effilée, le lit d’aval est de bonne qualité sans grosse collatérale et sans maladie extensive au niveau de la zone d’atterrissage, les collatérales proviennent de la coronaire droite et sont principalement septales et très tortueuses.
Photo 1. Angiographie de départ.
Ce patient présente par ailleurs une anomalie de naissance de la circonflexe provenant du sinus antéro-droit, et l’artère est de petit calibre avec une sténose serrée dans sa partie proximale. La coronaire droite est discrètement athéromateuse.
Stratégie a priori
Nous avons donc planifié la procédure et établi une stratégie basée sur le film diagnostique. La stratégie antérograde apparaît tout d’abord la plus adaptée compte tenu de la bonne visualisation et compréhension de l’entrée et de la sortie de la CTO et de la qualité de la zone d’atterrissage. De plus, la chape distale n’englobe pas de bifurcation diagonale majeure et les collatérales sont très tortueuses. Ces deux arguments ne plaident pas pour un abord rétrograde.
La stratégie sera donc d’aborder la CTO avec une escalade dans la dureté et le pouvoir de pénétration des guides. Compte tenu du degré de calcification mais surtout de la longueur de l’occlusion, on planifie (en cas d’échec) de changer rapidement de stratégie pour une approche de dissection réentrée antérograde.
Procédure
Abord antérograde EBU 3,5 en 8 F fémoral associé à un abord rétrograde 6 F radial. Un microcathéter Corsair (Asahi) est avancé jusqu’à l’occlusion sur un guide souple (SION Blue, Asahi) puis la lésion est « palpée » avec un Fielder XT-A (Asahi) sans pouvoir la pénétrer. Le guide souple est changé par un guide rigide (CONFIANZA PRO 12, Asahi) qui permet de ponctionner la chape proximale et d’avancer le nez du Corsair. Le Fielder XT-A est retenté mais n’a pas assez de puissance pour rester droit et avancer.
Un Pilot 200 (Abbott Vascular) arrive à avancer mais on constate rapidement qu’il s’agit d’un trajet sous-intimal (photo 2). Cet échec oblige à changer de stratégie. Le Corsair est remplacé par un cathéter CrossBoss™ (Boston Scientific) avec la technique du trapping balloon. À partir de ce moment, aucune injection antérograde n’est réalisée et la seringue est retirée du manifold. Le CrossBoss™ est avancé en sous-intimal grâce à une rotation très rapide ; il permet ainsi de créer un trajet sous-intimal limité et contrôlé afin de ne pas mettre en péril la qualité du lit distal par un hématome sous-intimal compressif, par exemple. Le cathéter dépasse facilement la CTO et se situe maintenant en regard de la zone de réentrée de l’IVA moyenne (photo 3).
Photo 2. Tentative de passage avec un guide et un micro cathéther.
Photo 3. Passage avec le CrossBoss™.
Le CrossBoss™ est retiré et remplacé par un cathéter ballon StingRay™(Boston Scientific) toujours avec la technique du trapping balloon en utilisant un guide Miracle 12 (Asahi) qui a la caractéristique d’être rigide jusqu’à son extrémité et de constituer un rail stable pour effectuer des échanges précis.
Le ballon StingRay™ est ensuite gonflé avec du produit de contraste pur à 4 atm afin de déployer ses 2 ailettes à plat dans l’espace sous-intimal. On cherche ensuite la meilleure incidence pour obtenir un parallélisme parfait entre la ligne que représente les ailettes du ballon et la lumière du vaisseau lors de l’injection rétrograde (photos 4).
Photos 4. A : Ballon de réntrée StinGray™ en position. B : Réentrée du guide StinGray™ au travers du ballon. C : Résultat final.
Le guide Miracle 12 est retiré au profit d’un guide StingRay™ extrêmement rigide (12 g de poussée) et effilé à l’extrémité afin de ponctionner l’épaisseur de tissu situé entre l’espace sous-intimal et la lumière du vaisseau. Il est déjà préformé à 1 mm pour pouvoir accéder aux ports proximal et distal du cathéter StingRay™.
Au premier essai, le guide s’engage dans le port proximal vers le haut de l’image en direction du péricarde : il est retiré et redirigé par une rotation de 180° vers le bas (port distal). Il existe une bonne différenciation entre l’axe de l’artère et le guide, On peut sentir dans le guide une forte tension élastique qui cède brutalement au passage dans la vraie lumière. Une fois la ponction faite, ce guide agressif et difficile à manier est retiré. Un guide polymérique de type Pilot 200 suivra ensuite le trajet juste réalisé pour aller dans la distalité du vaisseau.
Le ballon StingRay™ est alors dégonflé et retiré et un Corsair franchira la lésion distalement dans l’IVA. Un échange est effectuée pour un guide BHW (Abbott Vascular) qui servira pour l’angioplastie de la lésion et l’implantation de 84 mm de stents actifs Promus PREMIER™ 2,5 à 3,5 mm de diamètre™(Boston Scientific). L’angioplastie avec kissing de la bifurcation IVA-D1 est faite avec un excellent résultat angiographique final et le retour à domicile du patient le lendemain. Un traitement par bithérapie antiagrégante est prescrit pour une durée conseillée de 9 mois.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


