Training
Publié le 30 sep 2009Lecture 9 min
Faut-il réhabiliter la valvuloplastie aortique percutanée en 2009 ?
A. TIROUVANZIAM, Hôpital Laennec, Nantes
La valvuloplastie aortique percutanée au ballon (VAB) a été mise au point par A. Cribier en 1985(1) comme une alternative à la chirurgie de remplacement valvulaire, dans le rétrécissement aortique calcifié dégénératif contre-indiqué ou à haut risque chirurgical.
Après un engouement légitime lié à l’efficacité fonctionnelle et hémodynamique de la procédure, celle-ci a été abandonnée par la plupart des équipes en raison d’un taux de resténose majeur (85 à 100 % à 2 ans). La VAB connaît aujourd’hui un regain d’intérêt car elle est un prérequis indispensable à l’implantation d’une bioprothèse aortique percutanée.
Le principe de la technique n’a pas évolué en 20 ans, mais a gagné en simplicité et en sécurité grâce à l’amélioration du profil des ballons, le recours à la stimulation ventriculaire rapide, la fermeture vasculaire et les progrès de l’imagerie en salle de cathétérisme.
La technique
Deux types d’approche sont envisageables :
• la voie artérielle rétrograde, la plus utilisée ;
• la voie veineuse trans-septale antérograde. L’objectif est toujours une réduction du gradient transvalvulaire de 50 % et une surface aortique ≥ 1 cm2.
Approche rétrograde
Désilet de 8 F, veine fémorale, montée d’une sonde Swan Ganz.
Mesures hémodynamiques avec débit cardiaque et surface aortique.
Désilet 5 ou 6 F dans l’artère fémorale, coronarographie préalable, franchissement de l’orifice aortique avec un guide droit 0,035’’ et une sonde diagnostique (Pig Tail ou JR4 ou AL1).
Héparinisation (ACT 200 à 250 sec.). l Échange pour un guide Amplatz™ 0,035’’ de 2,6 m extra rigide dans le ventricule gauche.
Échange sur guide pour un désilet 11 ou 12 F.
Montée du ballon de 18, 20 ou 25 mm de diamètre sur 40 mm (ratio ballon/diam. de la chambre de chasse = 1/1).
Échange de la sonde Swan Ganz pour mettre en place une sonde d’entraînement électrosystolique dans le ventricule droit, testée à plus de 200/min. (arrêt de la systole mécanique pour stabilisation du ballon dans l’orifice aortique lors de l’inflation).
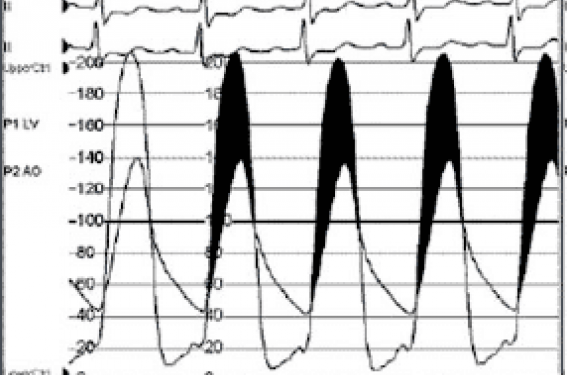
Positionnement du ballon dans le plan valvulaire aortique. Inflation courte jusqu’à disparition de l’empreinte. Arrêt de la stimulation ventriculaire rapide et mesure finale du gradient hémodynamique et de la surface (figure 1).
Compression manuelle ou fermeture par Prostar® XL ou Perclose (selon la technique du preclosing).
Figure 1. Évaluation hémodynamique par mesure du gradient VG-aorte avant et après valvuloplastie.
Approche antérograde
Cette approche est utile en cas d’artériopathie sévère des axes ilio-fémoraux (syndrome de Leriche, etc.).
• Abord veineux fémoral 8 F, mesures hémodynamiques.
• Cathétérisme trans-septal identique à la procédure de valvuloplastie mitrale.
• Héparinisation après catéthérisme trans-septal (ACT ≥ 200 à 250 secondes).
• Franchissement de l’orifice mitral, puis aortique au ballon Critikon®.
; Mesure du gradient transaortique.
• Montée d’un guide 0,021’’ de 2,60 m dans l’aorte ascendante puis descendante.
Un abord par la technique du « téléphérique » permet de capturer le guide par un désilet 5 F positionné dans l’artère fémorale controlatérale et de récupérer selon la technique du Gooseneck le guide 0,021’’ introduit par voie fémorale.
Échange sur une sonde 4 F du guide 0,021’’pour un guide 0,035’’ rigide de 2,6 m.
Montée et mise en place du ballon de valvuloplastie. Pas de stimulation obligatoire (ballon stable en inflation antérograde).
• Mesure des gradients et de la surface :
• Compression manuelle veineuse et fermeture artérielle.
Cette voie (historiquement la première utilisée par A. Cribier lors de la première implantation de valve en 2002) pourrait retrouver une place de choix, liée à la réduction du diamètre du dispositif implantable. Les résultats obtenus en termes d’amélioration de la surface aortique semblent du reste meilleurs qu’avec la technique rétrograde (figure 2).
Elle reste néanmoins délicate en raison de la réalisation du cathétérisme trans-septal, des manipulations complexes du matériel dans le ventricule gauche (notamment en cas de petit diamètre et d’hypertrophie) et, enfin, du risque de cisaillement de l’appareil valvulaire et sous-valvulaire mitral du fait de la rigidité du guide.
Figure 2. Amélioration de la surface aortique après valvuloplastie en fonction de la technique utilisée.
D’autres approches ont été essayées avec succès
La voie transjugulaire veineuse (avec cathétérisme trans-septal) semble plus simple pour le franchissement de la valve aortique que la voie fémorale, mais elle est plus complexe en ce qui concerne l’ergonomie et la radioprotection de l’opérateur.
La voie trans-sous-clavière (notamment gauche) paraît émerger comme une alternative intéressante à la voie transapicale. La réalisation de la VAB dans ce cas de figure nécessite un abord chirurgical et ne sera donc envisagée que dans la perspective de l’implantation d’une bioprothèse dans la foulée.
Résultats
Malgré une VAB réussie et spectaculaire sur l’amélioration des symptômes (tableau 1), ce bon résultat initial n’est jamais durable dans le temps. Le patient doit impérativement être prévenu de cela avant la réalisation de la procédure qui ne doit être présentée que comme un traitement palliatif.
En effet, malgré un degré variable de fracture des nodules calcaires intravalvulaires, avec clivage des plans fibreux et étirement de l’anneau, les valvules restent épaissies, peu flexibles et la morphologie globale de l’orifice finalement peu remaniée.
Les séries démontrent une amélioration de la surface aortique passant de 0,5 ± 0,18 cm2 à 0,82 ± 0,3 cm2 (p < 0,001), avec un taux de resténose hémodynamique de 50 à 60 % à 6 mois, 80 % à 1 an et quasiment 100 % à 2 ans(2) (figure 3).
Figure 3. Résultats hémodynamiques à 6 mois de la valvuloplastie.
Eltchaninoff et al.(3), sur une série de 148 patients consécutifs (dont 86 au-delà de 80 ans), rapportent des taux de mortalité opératoire de 2,7 %, d’AVC de 2 %, de fibrillation ventriculaire de 1 %, de BAV complet de 1,4 % et de complications vasculaires de 5 %. La survie à 1 an était de 73 %, 78 % des survivants ayant une amélioration fonctionnelle de la classe NYHA. Celle ci dure en moyenne de 12 à 18 mois dans le meilleur des cas.
Dans une étude plus récente, Pedersen et al.(4) rapportent, sur une série de 31 nonagénaires, une morbidité opératoire de 3,2 %, un taux d’AVC de 3,2 % et 0 % de complications vasculaires.
Notre registre 2009, regroupant 73 procédures consécutives (âge moyen : 83 ± 7 ans), retrouve quant à lui une mortalité opératoire de 1,5 %, des taux d’AVC de 1,5 % et de complications vasculaires de 1,5 %, avec 83 % de survie à 1 an, 70 % des patients survivants ayant une amélioration fonctionnelle persistante et une réduction associée significative des séjours hospitaliers pour décompensation cardiaque, syncope et angor.
La réduction des complications vasculaires suggère l’intérêt d’un screening préalable de l’abord artériel par l’imagerie et l’utilisation d’un système de fermeture tel que Prostar® XL ou Perclose (Abbott ) selon la technique du preclosing.
Une courbe d’apprentissage reste indispensable, a fortiori pour le cathétérisme transseptal utilisé pour la voie antérograde, car ce type de population âgée reste en effet davantage exposé à des complications peropératoires dramatiques et rapidement fatales : tamponnade par perforation ventriculaire au guide 0,035’’ rigide pour le ventricule gauche, avec la sonde d’entraînement électrosystolique pour le ventricule droit, rupture iliofémorale (hémorragie rétropéritonéale en cas de ponction haute), rupture annulaire (ratio ballon/chambre de chasse > 1), insuffisance cardiaque aiguë (en cas de dysfonction ventriculaire gauche préalable), infarctus myocardique (embolisation ou sténose d’un tronc épicardique principal), enfin, insuffisance aortique aiguë. Ces complications demeurent cependant extrêmement rares.
En cas de resténose avec dégradation de l’état fonctionnel et réapparition des symptômes, on peut envisager une nouvelle valvuloplastie au ballonnet qui apporte généralement une amélioration hémodynamique modeste ce d’autant que la resténose est plus précoce. Cette nouvelle valvuloplastie s’avère néanmoins efficace sur les symptômes et la classe NYHA avec une mortalité opératoire de 1 % et une survie à 1 an de l’ordre de 80 % superposables à la première valvuloplastie(5).
Les statines (étude SEAS : Simvastatin Ezetimibe in Aortic Stenosis), utilisées pour réduire la progression de la sténose aortique (dans l’hypothèse d’une physiopathologie similaire entre athérosclérose et sténose aortique), n’ont démontré aucune efficacité dans cette indication(6). Le recours à une irradiation externe par un faisceau de rayons X ciblant l’orifice aortique et les valves calcifiées dans les suites d’une valvuloplastie au ballon (essai pilote RADAR)(7) a démontré quant à lui une certaine efficacité, réduisant la resténose à 21 % après 12 mois sur une population très âgée (âge moyen : 89 ± 4 ans). Cette technique paraît néanmoins difficilement envisageable sur le plan pratique et éthique.
En ce qui concerne le ballon de valvuloplastie coaté au paclitaxel, les études menées sur le modèle animal pour la prévention de la resténose après valvuloplastie avec ce ballon paraissent difficilement extrapolables à la maladie de Mönckeberg chez l’homme. L’implantation percutanée d’une bioprothèse aortique dans la valve native pathologique apparaît dorénavant comme la seule option thérapeutique efficace des patients ayant une contre-indication à la chirurgie ou à haut risque chirurgical.
La VAB peut alors être effectuée à distance de l’implantation de la bioprothèse, en stand by de la procédure percutanée, mais dans tous les cas de figure, elle sera réalisée immédiatement avant, dans le même temps opératoire pour éventuellement préciser la taille de l’anneau (en cas de discongruence entre les mesures d’imagerie) et pour préparer le positionnement de la prothèse dans l’orifice calcifié.
Les indications validées de la valvuloplastie aortique percutanée au ballon dans le rétrécissement aortique dégénératif restent par ailleurs classiques, validées par les recommandations de l’ACC/AHA, et sont d’un niveau IIB et III de recommandations (tableau 2).
Bonow R et al. J Am Coll Cardiol 2006 ; 48 : 598-675.
Conclusion
La valvuloplastie aortique au ballon en 2009 doit être plus largement proposée aux patients et remise en perspective du fait de l’évolution permanente des bioprothèses implantables par voie percutanée, tant sur le plan technologique que par la multiplication à venir dans le choix des prothèses et des compagnies concernées. Ceci aboutit parallèlement à un élargissement des indications d’implantation au-delà de la seule sténose aortique non chirurgicale (insuffisance aortique, dégénérescence de bioprothèse, bicuspidie, etc.).
La valvuloplastie au ballon ne devrait donc pas demeurer une fin en soi mais la porte ouverte à de nouvelles options pour ces patients en impasse thérapeutique.
Ces belles perspectives sont évidemment conditionnées par les résultats des futures études et par le remboursement de l’acte.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


