Technologies
Publié le 25 mar 2024Lecture 7 min
L’« échec du stent » et l’apport de l’OCT
Gael BOUCHOU, CHU de Saint-Étienne
Le stenting coronarien a transformé la stratégie de revascularisation, produisant d’excellents résultats procéduraux et cliniques dans de nombreuses situations cliniques. Malgré de nombreuses améliorations dans la conception et les revêtements polymères des stents au cours des deux dernières décennies, la resténose intrastent (RIS) et la thrombose de stent (TS) regroupées sous le terme « échec du stent » qui restent des complications difficiles à traiter.
L'imagerie endocoronaire (IEC) a permis une meilleure compréhension des mécanismes impliqués, conduisant à proposer une prise en charge standardisée.
IDENTIFICATION DU MÉCANISME DE LA RIS
La RIS est un rétrécissement progressif d'un segment du stent qui reste un phénomène fréquent dans la pratique quotidienne. L'incidence de la RIS est de 10 % des angioplasties (PCI), de plus, 25 % des cas de RIS se présentent avec un infarctus aigu du myocarde (IDM). La RIS génère des coûts de santé importants et est associée à un risque accru de décès et de réhospitalisations(1).
La stratégie thérapeutique privilégiée dépend d’un diagnostic précis et d’une compréhension de la cause. Par conséquent, identifier le mécanisme dans chaque cas en utilisant la tomographie à cohérence optique (OCT) est une étape cruciale. En ce qui concerne les mécanismes, l’OCT permet de distinguer des facteurs biologiques et des facteurs mécaniques, qui nécessitent tous deux une approche différente.
La cause mécanique
La principale cause mécanique de la RIS est la sous-expansion. Cela peut résulter d’une préparation insuffisante de la lésion initiale, d'un sous-dimensionnement du stent ou de faibles pressions de déploiement (figure 1).
Figure 1. Sous-expansion d'un stent, due à une préparation insuffisante de la plaque calcifiée.
La cause biologique
Le principal mécanisme biologique de la RIS est l’hyperplasie néo-intimale : une cicatrisation homéostatique exagérée en réponse à des lésions de la paroi artérielle lors de l’implantation du stent (figure 2). Si l’hyperplasie néo-intimale se caractérise par des dépôts riches en lipides ou des calcifications, on parle alors de néoathérosclérose (ou néoathérome) (figure 3)(2).
Figure 2. Hyperplasie néo-intimale dans un stent correctement déployé.
Figure 3. A'-C' : Illustrations de A-C, mais avec des annotations. Les lignes pointillées vertes indiquent les anciennes mailles de stent. A : Néoathérosclérose lipidique B : Néoathérosclérose calcifiée C : Hyperplasie néo-intimale. A' : Une région circonférentielle avec une forte atténuation du signal indique un tissu lipidique (*). B' : Calcium avec une bordure claire entourant les mailles du stent (*). C' : Tissu homogène en hypersignal indiquant une hyperplasie néo-intimale fibreuse (*).
TRAITEMENT DE LA RIS
Le principe essentiel est d’obtenir le plus grand gain de lumière possible en maximisant la zone luminale minimale immédiate. Pour opérationnaliser ce concept, une évaluation diagnostique complète de la cause de la RIS doit être effectuée. Le traitement de la RIS repose sur trois constatations importantes sur l’OCT :
• Y a-t-il une sous-expansion initiale du stent ?
• Y a-t-il plusieurs couches de stent ?
• Y a-t-il une néoathérosclérose ?
Sur la base de ces trois questions, soit une postdilatation de l’ancien stent peut suffire, soit il faut traiter avec un stent actif ou un ballon actif. Un algorithme est proposé dans la figure 4.
Figure 4. Algorithme de traitement de la RIS, proposé par G. Souteyrand et N. Amabile.
IDENTIFICATION DU MÉCANISME DE LA TS
Bien que des données récentes indiquent que le taux d'incidence global pourrait ne pas dépasser 1 % par an des PCI, les conséquences potentielles d’une TS peuvent être dévastatrices, notamment une mortalité élevée. Comme pour la RIS, un diagnostic précis par OCT est nécessaire. Dans l’étude PESTO, un registre multicentrique prospectif incluant les patients avec TS confirmée, l’OCT a permis d'Identifier une anomalie morphologique dans 97 % des cas, notamment : malapposition des mailles (34 %), lésions néoathéroscléreuses (22 %), sous-expansion majeure du stent (11 %), évagination coronarienne (8 %), mailles non couvertes (8 %), progression de la maladie liée aux bords (8 %) et hyperplasie néo-intimale (4 %) (figure 5)(3).
Figure 5. Exemples représentatifs de mécanismes de la TS explorés par OCT après une résorption du thrombus. A : Thrombose aiguë de stent : dissection de bord. B : Thrombose sub-aiguë de stent : malapposition majeure du stent. C : Thrombose tardive de stent : mailles non couvertes. D : Thrombose très tardive de stent : lésion de néoathérosclérose. E et F : Lésion néoathéroscléreuse rompue. G : Sous-expansion majeure du stent avec mesures de la zone du stent et de la zone de la lumière de référence. H : Évaginations coronaires liées à un remodelage positif sous-jacent.
TRAITEMENT DE LA TS
L’optimisation du déploiement du stent avec une expansion appropriée du ballon à haute pression doit être effectuée. L’implantation d’un stent supplémentaire doit être évitée dans la mesure de possible car la probabilité de récidive de TS augmente proportionnellement à la longueur du stent.
Cependant, le traitement des dissections des bords et de la progression de la maladie avec des stents supplémentaires est impératif pour éviter une répétition de la TS.
REVUE DES ÉTUDES CLINIQUES
L'OCT ne joue pas seulement un rôle dans la prise en charge de l’échec du stent, elle améliore également les résultats cliniques dans d’autres lésions complexes. Cela a été prouvé dans une série d’études cliniques publiées ces derniers mois.
Tout récemment, une métaanalyse dirigée par G. Stone et publiée dans le Lancet, a regroupé 22 études randomisées analysant l’ACT guidée par l’imagerie endocoronaire, soit presque 16 000 patients étudiés. Dans cette méta-analyse, le guidage par OCT ou IVUS réduit de manière formelle la mortalité toutes causes (25 %), diminue le risque d’IDM de tout type (17 %) et le risque de revascularisation répétée (28 %) comparativement à l’ACT guidée par l’angiographie seule. Les résultats étaient similaires pour l’OCT et pour l’IVUS(4).
Récemment, en mars 2023, les résultats de RENOVATE-PCI ont été présentés à l’ACC. L’étude randomisée a comparé l’angioplastie (ACT) guidée par l’imagerie endocoronaire (25 % d’OCT et 75 % d’IVUS) à l’ACT standard guidée par l’angiographie. Les résultats ont montré une réduction statistiquement significative du critère primaire TVF (target vessel failure) dans le bras imagerie endocoronaire (OCT/IVUS 7,7 % vs angio seule 12,3 % ; p = 0,008)(5). Plus tard dans l’année, 3 grandes études randomisées contrôlées ont été présentées à l’ESC avec publications simultanées dans des journaux à fort impact. La première, ILUMIEN-IV a inclus des patients avec des lésions complexes en montrant que le guidage OCT améliore significativement les résultats procéduraux en comparaison avec le guidage angiographique sur un critère primaire d’imagerie, la surface minimale en zone stentée (MSA), paramètre directement associé à la survenue d’événement clinique. Cependant, aucun bénéfice clinique n’a pu être démontré sur le principal critère secondaire (TVF) malgré une réduction statistiquement significative du taux de thromboses de stent en cas d’ACT sous imagerie (0,5 % dans le bras OCT vs 1,4 % dans le bras angio à 2 ans ; p = 0,02)(6).
Ensuite, l’étude OCTOBER, comparant une stratégie guidée par l’OCT à une stratégie guidée par l’angiographie pour le traitement des bifurcations, a montré une réduction des MACE à 2 ans en faveur du groupe OCT (10,1 % dans le bras OCT vs 14,1 % dans le bras angio ; p = 0,035)(7). Enfin, l’essai OCTIVUS a également été présenté : une étude de non-infériorité qui a comparé l’OCT à l’IVUS. Plus de 2 000 patients ont été inclus et il n’y avait pas de différence significative entre les deux groupes pour guider une angioplastie à 1 an(8).
CONCLUSION
L’imagerie endocoronaire en 2024 est devenue un outil indispensable pour l’optimisation des résultats d’angioplastie coronaire, à court et long terme, en réduisant de manière significative la resténose, la thrombose de stent et la mortalité.
La limite à son utilisation reste, actuellement, l’absence de remboursement, générant des surcoûts non négligeables. Au vu des dernières données scientifiques, une analyse médico-économique devrait faire reconsidérer son financement dans le but d’améliorer la prise en charge de nos patients.
CAS CLINIQUE
Prise en charge de la TS
➜ Il s’agit d’un patient de 75 ans, diabétique, hypertendu, aux antécédents d’IDM antérieur 8 ans plus tôt, qui a été traité par l’implantation d’un stent actif à l’ostium de l’IVA.
Le patient est admis en salle de coronarographie pour STEMI latéral compliqué d’un arrêt cardiorespiratoire sur FV récupérée. En début d’examen, il y a eu une régression des signes cliniques et électriques.
La coronarographie objective un volumineux thrombus du tronc commun distal, TIMI 3 dans l’IVA et la Cx (photo 1).
Photo 1. Coronarographie : thrombus dans le tronc commun distal.
La décision a été prise de poursuivre une anticoagulation efficace associée à une bithérapie antiplaquettaire avant de faire un contrôle angiographique à J5. Le contrôle à J5 confirme la disparition angiographique des images thrombotiques (photos 2 et 3).
Photo 2. Contrôle à J5 : disparition angiographique du thrombus.
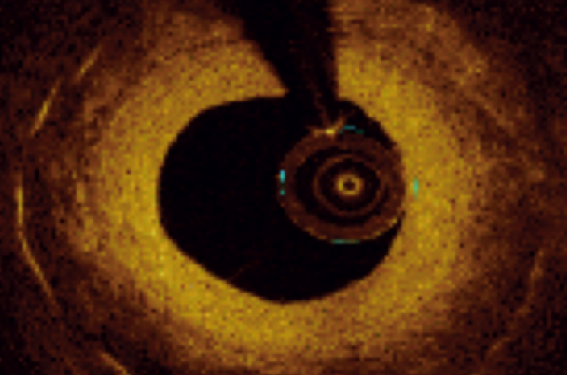
Photo 3. Analyse OCT : protrusion du stent dans le TC résultant d’une malapposition sévère.
Pour mieux comprendre le mécanisme du TS, il a été décidé d'effectuer une analyse OCT, qui a permis de visualiser une protrusion dans le tronc commun du stent implanté sur l’IVA 8 ans plus tôt, résultant d’une malapposition sévère, responsable de l’événement thrombotique.
Tenant en compte cette découverte, il a été décidé de procéder avec un traitement par angioplastie avec stenting de l’axe TCCG-Cx en « culotte » à travers l’ancien stent de l’IVA, après avoir confirmé la bonne position du guide à travers la maille en OCT (photo 4). Un contrôle final en OCT a été réalisé, confirmant la correction complète de la malapposition (photo 5).
Photo 4. Angiographie après stenting TCCG-CX.
Photo 5. Contrôle final en OCT, visualisant la correction complète de la malapposition.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


