Nouvelle technique
Publié le 30 mar 2025Lecture 11 min
Laser coronaire en 2025 : un outil multi-fonction
Jérôme BRUNET, Jean-Pascal PEYRE, Antoine BOGE, Annick ASTIÉ-DARDAILLON, Cédric MAZEAU, François-Xavier HAGER, Clinique Rhône-Durance, Avignon
Face à l’indétrônable athérectomie rotationnelle et aux nouveaux outils de préparation du vaisseau (athérectomie orbitale, lithotripsie intravasculaire), il est légitime de s’interroger sur la place qui reste à accorder au laser. Cet outil utilisé dès le début des années 1980, traine une sulfureuse réputation qualifiée encore aujourd’hui de technique dangereuse, compliquée et inutile. Le moment n’est-il pas venu de moderniser la vision du laser coronaire et de préciser les indications qui pourraient en découler ?
LE MATÉRIEL
Le laser (light amplification by stimulated emission of radiation) de type Excimer est produit par l’application d’un voltage élevé à une solution dimérique de xénon et d’hydrogène chloré (Excimer, pour excited-dimer), avec comme conséquence la formation de photons.
Le système comporte trois éléments :
– le générateur : console Nexcimer (Philips Laser System), venu remplacer l’encombrante et bruyante unité CVX-300 (figure 1) ;
– les cathéters venant délivrer l’énergie excimer via des fibres optiques ;
– la pédale de commande permettant de délivrer le tir.
Figure 1. Console Nexcimer (Philips IGTD).
Le générateur émet l’énergie laser via un cathéter de sortie à une longueur d’onde de 308 nm, une longueur d’impulsion de 185 ns, une énergie comprise entre 30 et 80 mJ/ mm2 à une fréquence de répétition d’impulsion comprise entre 25 et 80 Hz. Cette nouvelle unité d’alimentation Nexcimer permet de s’affranchir du long et fastidieux temps de préchauffage du modèle CVX-300 et reste commune aux différentes applications coronaire, vasculaire périphérique et rythmologique (extraction de sondes). La calibration préalable de la fibre laser reste requise.
Les fibres Excimer laser coronaire d’athérectomie, dites ELCA™ (Spectranetics), sont monorails (figure 2), compatibles 0,014’’ quel que soit le guide, polymérique ou non, et disponibles en 4 diamètres (0,9 mm et 1,4 mm en cathéter guide 6 F, 1,7 mm en GC-7 F, 2,0 mm en GC-8 F). La gamme vasculaire (Turbo-Elite, TurboPower) se compose quant à elle de fibres co-axiales, et est disponible en diamètre s’échelonnant de 0,9 à 2,3 mm.
Figure 2. Fibre monorail ELCA™ (Philips IGTD).
En pratique, la mise en œuvre se fait en moins de 3 minutes de la mise sous tension de la console jusqu‘à l’athérectomie proprement dite, en monorail, et sans avoir à passer par l’étape préalable d’échange pour un guide spécifique. Tout l’inverse donc d’un système compliqué d’utilisation.
MÉCANISME D’ACTION DU LASER EXCIMER
Principes généraux
Le principe du laser Excimer est la production de photons par application d’un voltage élevé à une solution dimérique de xénon et d’hydrogène chloré. C’est l’absorption de l’énergie photonique par les composants non acqueux de la plaque athéroscléreuse qui va produire l’effet d’ablation. Le laser Excimer s’exprime dans l’ultraviolet avec une courte longueur d’onde à 308 nm. Schématiquement, la profondeur de pénétration du laser est inversement proportionnelle à sa longueur d’onde : avec un laser à courte longueur d’onde, caractéristique du laser Excimer, il y a moins de pénétration, moins de génération de chaleur et moins de dommages aux tissus adjacents. La profondeur d’absorption du laser Excimer est d’environ 50 μm, agissant ainsi conceptuellement comme un laser froid de contact. On voit donc ici un outil totalement différent du laser YAG utilisé dans les années 1980, émettant dans la gamme infrarouge avec longueur d’onde beaucoup plus importante.
Mécanismes d’action
L’ablation des tissus est médiée par trois mécanismes distincts.
• Photochimique : rupture des liaisons moléculaires carbone-carbone sous l’effet de la lumière laser UV absorbée par le matériel intravasculaire.
• Photothermique : vaporisation des tissus. La rupture des liaisons carbone augmente la température de l’eau intracellulaire, provoquant une dégradation cellulaire et générant une bulle de vapeur à l’extrémité du cathéter.
• Photomécanique : l’expansion puis l’implosion de la bulle de vapeur brisent la plaque, mais aident également à éliminer les sous-produits de l’ablation (eau, gaz et petites particules). Les sous-produits de la photoablation ont un diamètre inférieur à 10 μm et sont facilement filtrés par la microcirculation, réduisant le risque d’obstruction microvasculaire et les phénomènes de no-reflow.
Un outil multifonction
• Composition du milieu dans lequel est délivré le tir
Les instructions d’utilisation du laser mentionnent que l’infusion de sérum salé en cours de tir est recommandée. Pour faire simple, l’intensité de l’énergie mécanique produite par un tir laser est directement liée à la quantité de ponts cellulaires (liaisons carbone-carbone) rompus par l’absorption de la lumière UV, donc à la composition du milieu dans lequel est délivré le tir.
Si le tir est délivré dans du sang, ou à l’extrême, dans un milieu enrichi en ponts carbone comme le produit de contraste iodé, la réaction induite par la rupture des liaisons cellulaires sera littéralement explosive, engendrant la formation d’une bulle de vapeur (ou bulle de cavitation). Nous aurons alors, non seulement la désintégration de la plaque au contact de la sonde laser (effet endoluminal), mais surtout l’émission d’ondes de choc acoustiques se propageant radialement en direction de la paroi vasculaire (effet blast disruptif). L’énergie produite par l’onde de choc acoustique peut atteindre jusqu’à 15 kbar avec la plus forte concentration de produit de contraste iodé.
À l’inverse, si le tir est délivré en milieu salin, très pauvre en pont s carbone, l’impact du tir laser sera limité à l’effet endoluminal. Il n’y aura pas de formation de microbulles de cavitation, limitant ainsi au maximum l’intéraction avec les tissus adjacents par limitation du choc acoustique. Ce mode d’utilisation sécuritaire, conforme aux instructions d’utilisation, est bien adapté aux lésions molles ou thrombotiques, mais beaucoup moins efficace sur les lésions fibrocalciques, expliquant sans doute les expériences décevantes rencontrées en début d’expérience sur ce type de lésion et le procès en inefficacité qui a pu en résulter.
• Réglages de l’intensité du tir
Outre la modification des conditions dans lesquelles sera délivré le tir, et de manière à s’adapter aux dif érentes lésions rencontrées – lésions résistantes fibrocalciques ou au contraire thrombus et tissus mous –, l’opérateur aura la possibilité de moduler l’intensité de la photoablation en modifiant sur la console le réglage de deux paramètres : l’énergie émise par le cathéter à chaque impulsion ou fluence (plage : 30 à 80 mJ/mm2) et la fréquence de répétition des impulsions par secondes ou rate (plage : 25 à 80 Hz).
COMMENT RÉUSSIR UNE PROCÉDURE LASER
(figure 3)
Figure 3. Utilisation pratique et indications du laser coronaire.
Une avancée lente de la fibre laser
C’est une constante, de manière à laisser la photoablation opérer, mais aussi à optimiser le diamètre d’athérectomie. Dans notre expérience vasculaire périphérique, le tunnel d’athérectomie produit par une fibre de 2,3 mm TurboElite, s’il ne dépasse pas 3 mm à vitesse rapide, va atteindre 4,4 mm avec une avancée lente (mesures IV US, lésions de resténose intrastent fémoropoplitées). Idéalement, cette vitesse doit être de 0,5 à 1 mm/s, en rappelant que chaque séquence comprend un tir qui ne peut excéder 10 secondes (coupure automatique avec les fibres ELCA™), suivi d’une période de repos de 5 secondes. Un minimum de 2 à 3 passages est requis.
Le protocole « lésions résistantes »
Pour des situations de franchissement de lésions dites « infranchissables », de lésions complexes fibrocalciques, de redéploiement de stent, l’effet disruptif va être recherché, requérant la technique de perfusion de contraste (lasing-incontrast) associée à des tirs à haute énergie. Dans ces situations, le choix du diamètre de la fibre est relativement simple, il s’agit de la plus petite (ELCA™ 0,9 mm) pour des raisons évidentes de trackabilité, mais aussi car elle-seule permet de délivrer une énergie et une cadence de tir maximale (fluence 80 mJ/m² et rate 80 Hz).
Le protocole « lésions molles »
L’objectif est ici d’obtenir un nettoyage endoluminal. L’effet disruptif pariétal ne va pas être recherché, une irrigation saline en cours de tir est donc mise en place (lasing-in-saline), soit manuellement ou soit à l’injecteur (fonction KVO chez Assist), en appliquant alors un protocole de tir à basse énergie. Le calibre de la fibre est ajusté en fonction du calibre du vaisseau, en particulier pour les coronaires dystrophiques anévrismales ou sur les ponts saphènes. La fibre ELCA™ 1,4 mm reste 6 F compatible, la fibre ELCA™ 1,7 mm impose un cathéter guide 7 F.
LES COMPLICATIONS
Il résulte du caractère filoguidé de la fibre, et de la pénétration laser n’excédant pas 50 µm, un taux de complication extrêmement faible comme le montre le large registre britannique rapporté en 2024 par P. O’Kane.
Dans notre expérience, sur une pratique laser initiée en 2013, regroupant environ 400 patients, aucune complication n’a été recensée sur une utilisation « saline ». En revanche, l’utilisation intensive et répétée de contraste, et les bulles de cavitation qui en résultent, exposent à un risque de slow flow, à utiliser donc avec parcimonie sur une artère coronaire unique et/ou une dysfonction VG sévère. Enfin, le protocole d’infusion de contraste doit encore être affiné, en termes de volume, de concentration de produit, mais aussi de site d’injection. Une haute concentration de contraste injectée distalement via un GCE, au contact d’une lésion occlusive, conjuguée à un tir laser simultané va inéluctablement amplifier l’effet blast et majorer alors le risque de complication.
NOS INDICATIONS
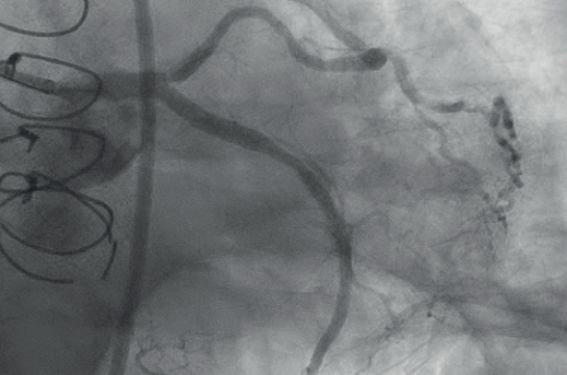
Lésion infranchissable (cas 1)
Cas 1. Reprise CTO pour angor d’effort postpontage.
A : CTO massivement calcifiée tronc commun-circonflexe ostiale. b : Circonflexe non protégée par le pont AMID-bissectrice. c : Franchissement rétrograde IVUS-assistée via le pont AMID. d :
Lésion infranchissable. Laser contraste antérograde (ELCA™ 0,9 mm) sur GCE. e : Résultat final après stenting.
On entend par infranchissable une lésion dans laquelle rien ne passe, excepté le guide 0,014’’, et ce malgré toutes les méthodes habituelles (amélioration du support par changement de KT guide, anchoring sur une collatérale, GCE au contact, mini-ballon de CTO, changement de microcathéter, etc.).
S’il s’avère impossible de passer le microcathéter et/ou d’échanger pour un Rotawire™ (Boston Scientific), c’est indiscutablement l’indication princeps du laser, véritable game-changer dans cette situation. La sonde ELCA™ 0,9 mm est engagée dans le GCE, réglée à intensité maximale 80/80, avec un tir délivré avec injection de contraste pour faciliter le franchissement. Rapidement convaincu par l’excellent profil efficacité/sécurité, notre algorithme actuel est de venir dégainer le laser plus précocément, sans multiplier les étapes prélables venant au final alourdir la facture.
S’il arrive malgré tout que l’ELCA™ ne soit pas capable de franchir, l’expérience montre que la modification de la chape proximale est en général suffisante pour que le ballon ou le microcathéter puisse franchir. Une synergie entre les différents outils est alors envisageable : stratégie Raser combinant ELCA™ et athérectomie rotationnelle, par exemple.
Par extension, ce protocole peut être appliqué aux lésions franchissables non dilatables avec empreinte persistante malgré de hautes pressions d’inflation, a fortiori si l’anatomie ne se prête pas à l’athérectomie rotationnelle (sinuosités, petits vaisseaux, lésion distale, etc.).
L’infarctus du myocarde ou le « mimi-laser »
La difficulté à recanaliser l’occlusion aiguë d’une énorme coronaire anévrismale, véritable cauchemar thrombotique pour l’angioplasticien, est en passe de devenir de l’histoire ancienne. L’utilisation de l’ELCA™ en première intention, en mode irrigation saline, dès le passage du guide, permet en général de rétablir un flux après 2 à 3 passages à énergie minimale, d’éviter une embolisation distale, et de mettre alors en place une stratégie MIMI. Le ratio fibre/diamètre du vaisseau doit être soigneusement analysé. Cette indication représente la majorité des sondes ELCA™ 1,7 mm utilisées dans notre centre (7 F compatibles).
Par analogie, les CTO LotusRoot sont abordées de la même manière. Enfin, la maladie du greffon saphène, qu’elle soit thrombotique en phase aiguë ou chronique (CTO), peut être efficacement traitée selon le même protocole. Il s’agit certes d’une indication de niche, mais aucune embolisation athérothrombotique, complication redoutable, n’a été déplorée avec cette nouvelle approche.
La resténose intrastent (RIS)
En termes de volume d’activité, il s’agit aujourd’hui de la principale indication de l’ELCA™. Sont abordées en première intention par cette technique toutes les RIS diffuses, prolifératives, occlusives ou récidivantes, en s’aidant la plupart du temps d’une imagerie endocoronaire.
L’ELCA™ permet de traiter la resténose en nettoyant de manière la plus exhaustive possible la prolifération intimale. Elle permet également de traiter simultanément un des facteurs causal de la resténose. L’effet blast va modifier la compliance du vaisseau (calcifications profondes) et autoriser ainsi la correction d’un sous-déploiement de stent par inflation additionnelle d’un ballon haute pression après ELCA™- contraste.
Concernant le choix de la sonde, l’objectif de nettoyage endoluminal optimal milite, comme dans l’infarctus, pour le choix d’une grosse fibre, à pondérer néanmoins par la difficulté potentielle de franchissement en cas de protrusion de maille.
L’ELCA™ n’est qu’un outil de prétraitement, reste à appliquer le traitement proprement dit, pour lequel il n’y a pas encore de véritable consensus. Peu de recul encore sur l’efficacité clinique à terme du traitement combiné laser + ballon actif, mais cette association semble très prometteuse dans cette indication, ouvrant en tout cas des perspectives de non-remétallisation systématique. Clairement, un meilleur gain luminal et moindre aspect de « millefeuille » en cas de redo-stenting après ELCA™ pour RIS.
Cas 2. Angor d’effort.
A : Courte occlusion massivement calcifiée CD2. Échec du Rotawire™ sur MC. B : Laser contraste (ELCA™ 0,9 mm). C : Résultat final après stenting.
Cas 3. STEMI H4.
A : Thrombose aiguë coronaire droite dystrophique. B : Laser saline en 1re intention dès le passage du guide (ELCA™ 1,7 mm). C : Rétablissement d’un flux TIMI 3, pas d’embolisation distale, avec résolution du susST. D : Contrôle à J7. E : Résultat final.
Cas 4. SCA tropo(+) avec IVG sur atteinte tritronculaire radique.
A : Resténose intrastent coronaire droite diffuse et multirécidivante. B : IVUS CD2 proximale : déploiement insuffisant du stent. C : ELCA™ 1,4 mm CD1 à CD3 (avec contraste en regard du stent non expandu). D : Ballon NC 4 mm à haute pression puis DCB 4 mm (boost). E : Expansion satisfaisante du stent. F : Résultat final.
CONCLUSION
• Le laser coronaire apparaît donc comme un outil multifonction, véritable couteau suisse, permettant de traiter en toute sécurité tout un éventail de lésions, de la plus thrombotique à la plus résistante.
• Le point fondamental reste sa simplicité de mise en œuvre. Contrairement à d’autres technologies de préparation du vaisseau, le laser présente l’avantage procédural de ne nécessiter aucun dispositif pour franchir la lésion autre que le guide 0,014’’, convertissant en succès une procédure vouée à l’échec lorsqu’un microcathéter, Rotawire™ ou Viperwire™, ne peuvent franchir.
• Outre un franchissement facilité, l’approche moderne d’ELCA™, développée dans notre centre dès 2019, venant chercher l’effet disruptif apporté par l’utilisation en routine de l’injection de contraste, comble le déficit d’efficacité sur le calcium, qu’il soit superficiel ou profond, permettant notamment d’optimiser l’expansion d’un stent non correctement déployé ou d’ouvrir une lésion indilatable.
• Le propos n’est pas ici de comparer ou de hiérarchiser telle ou telle technique, qui peuvent d’ailleurs très bien être envisagées de manière séquentielle et synergique, mais d’illustrer la polyvalence sans équivalent de cet outil, restant à ce jour la seule et ultime option de franchissement d’une lésion infranchissable.
Pour en savoir plus
• Golino L et al. Intern J Cardiol 2022 ; 19-26 ; doi: 10.1016/j. ijcard.2021.12.054.
• Hesse K et al. J Invasive Cardiol 2024 ; doi: 10.25270/jic/23.00267.
• Hinton J et al. Catheter Cardiovasc Interv 2024 ; 104(1) : 27-33. doi: 10.1002/ccd.31080.
• Mohandes M et al. Cardiol J 2024 ; 31(2) : 235-42. doi: 10.5603/cj.96438.
• Vizzari G et al. Catheter Cardiovasc Interv 2024 ; 104(2) : 220-6. doi: 10.1002/ccd.31141.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


