Complication
Publié le 31 aoû 2012Lecture 5 min
TAVI : critères de jugement et gestion des complications
S. GHOSTINE, Centre chirurgical Marie Lannelongue, Le Plessis Robinson
Le rétrécissement aortique calcifié (RAC) serré et symptomatique non traité est associé à une mortalité importante. Si le remplacement valvulaire chirurgical reste le traitement de choix, l’implantation par transcathéter de valve aortique (TAVI) est une alternative pour les patients ayant une contre-indication à la chirurgie ou à très haut risque opératoire en raison d’un âge avancé ou de multiples comorbidités.
Depuis l’implantation par le Pr A. Cribier de la première valve en 2002, plusieurs études et registres ont démontré la faisabilité et le bénéfice du TAVI comparativement à la chirurgie. Afin de permettre la comparaison de ces études, le consensus VARC (Valve Academic Research Consortium) publié en 2011 propose une standardisation des critères de jugement et des événements indésirables à répertorier(1).
La mortalité globale et cardiovasculaire
La gravité du RAC non opéré est confirmée par la cohorte B de l’étude PARTNER chez les patients ayant une contre-indication à la chirurgie(2). Malgré la valvuloplastie au ballon pratiquée dans 84 % des cas dans le groupe conventionnel, la mortalité à 1 an atteint 50 % contre 30 % dans le groupe TAVI.
Cette baisse de mortalité est confirmée par la cohorte A de l’étude PARTNER chez les patients à haut risque opératoire, où le TAVI est non inférieur à la chirurgie à J 30, à 1 an et à 2 ans(3) (tableau). Les femmes et les patients sans antécédents de pontage présentaient moins de mortalité dans le groupe TAVI versus chirurgie.
Le registre FRANCE 2 exhaustif sur 3 195 TAVI, confirme les excellents résultats des centres français, avec des mortalités globale et cardiovasculaire à 1 an identiques à celles de PARTNER A, respectivement de 24 % et 14,3 %(4) (tableau). À noter que la mortalité opératoire est largement surestimée par les scores de risque. Elle n’est que de 6,5 % dans PARTNER A. Les mêmes résultats sont retrouvés dans FRANCE 2 avec des chiffres prédits par le logistic EuroScore correspondant plutôt à ceux de la mortalité à 1 an.
Les facteurs prédictifs indépendants de mortalité comportent les scores de risque, l’insuffisance rénale et hépatique, l’insuffisance mitrale sévère, l’importance du gradient moyen transvalvulaire, la classe NYHA 3 ou 4, la voie transapicale et l’insuffisance aortique périprothétique ≥ 2.
Les accidents vasculaires cérébraux (AVC)
Dans PARTNER A, les AVC sont deux fois plus importants dans le groupe TAVI. Ils sont majoritairement procéduraux, et ischémiques, imputables à des emboles cruoriques ou athéromateux provenant de la valve native ou de l’aorte. Aucune différence n’est constatée selon la voie d’abord pratiquée. Au-delà de J 30, l’incidence des AVC hémorragiques est plus importante dans la cohorte B de PARTNER. Ces accidents graves, d’étiologies multiples, doivent inciter à redéfinir le traitement antithrombotique post-TAVI au regard de l’âge avancé des patients, de la fréquence des fibrillations atriales et des traumatismes crâniens.
Les complications vasculaires majeures
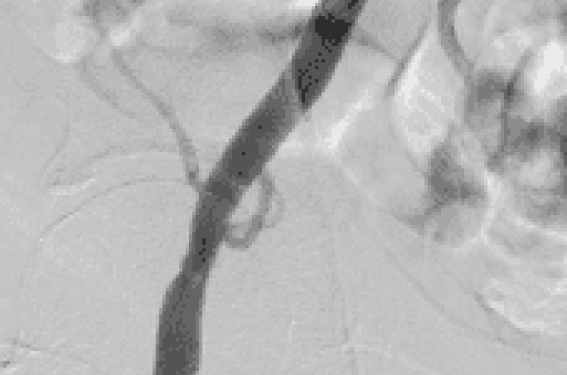
Elles sont plus nombreuses dans le groupe TAVI et concernent essentiellement la voie transfémorale. La miniaturisation des cathéters (du 26 au 18 F) et la sélection des patients selon la tortuosité et les calcifications des axes iliofémoraux au scanner, permettent de diminuer les risques (figure 1). Si la voie percutanée a été utilisée chez 76 % des patients dans le registre FRANCE 2, force est de constater que ces complications ont diminué à 5,5 % versus 11 % dans PARTNER A. Mais les accidents liés à l’utilisation du système de suture artérielle percutanée Prostar® doivent être rapidement diagnostiqués et traités (figures 2 et 3).
Figure 1. TAVI sans complications.
Figure 2. Complications vasculaires ischémiques post-Prostar® et traitement.
Figure 3. Complications vasculaires hémorragiques post-Prostar® et traitement.
Un abord fémoral controlatéral avec un cross over est nécessaire pour une ponction antéropostérieure et médiane de l’artère fémorale commune (AFC) loindes calcifications pariétales antérieures et de la bifurcation du trépied fémoral. Cet abord permettra également de traiter en endovasculaire d’éventuelles dissections, sténoses, saignements ou rupture d’artère. Une solide formation en cathétérisme vasculaire périphérique et une parfaite connaissance du matériel s’imposent comme un prérequis au cardiologue interventionnel pratiquant le TAVI pour éviter une double courbe d’apprentissage.
Les complications hémorragiques
Elles sont moins fréquentes dans le groupe TAVI versus chirurgie dans PARTNER A. La voie transfémorale présente moins de risque hémorragique que les voies transapicales ou sous-clavières dans FRANCE 2.
Les troubles de conduction
Ils sont très fréquents, atteignant jusqu’à 82 % des procédures, dont 50 % se produisent avant l’implantation de la valve(5). La CoreValve (Medtronic) est associée à une incidence accrue de bloc atrioventriculaire (BAV III) et de nécessité de pacemaker dans 20-40 % des cas selon les études, contre 6-12 % pour la Sapien (Edwards). Le bloc de branche droit (BBD) préexistant et une implantation basse de la valve sont les principaux facteurs prédictifs.
L’insuffisance aortique périprothétique
L’IA est rare après chirurgie, mais plus fréquente post-TAVI. Elle est induite par une apposition circonférentielle incomplète dans l’anneau aortique. L’IA ≥ 2 est un facteur prédictif indépendant de mortalité hospitalière.
La mesure de l’anneau aortique est primordiale pour déterminer la taille de la valve. Elle repose sur la confrontation de plusieurs examens comprenant l’échographie et le scanner cardiaque. Un anneau sous-dimensionné expose à une rupture soit lors de la valvuloplastie, soit lors de l’impaction de la valve (figure 4).
Figure 4. Rupture de l’anneau aortique.
Un anneau surdimensionné expose à une IA périprothétique. De même une CoreValve basse implantée ou une Sapien supraannulaire exposent au même risque (figures 5 et 6). Dans les deux cas, l’implantation d’une deuxième valve « in valve » permet d’y remédier. Ces implantations valvulaires multiples atteignent 2 % des procédures.
Figure 5. Valve « in valve » Sapien (Edwards).
Figure 6. Valve « in valve » CoreValve (Medtronic).
Conclusion
Le TAVI est comparable à la chirurgie du RAC chez les patients contre-indiqués ou à haut risque opératoire sur des critères robustes tels que la mortalité globale et cardiovasculaire.
Si l’incidence des AVC reste un problème à résoudre, les complications vasculaires et l’IA périprothétique tendront à s’amenuiser avec les évolutions techniques, la multiplicité de taille des valves, la sélection des patients, la formation et surtout la courbe d’apprentissage des opérateurs.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


