Cardiologie générale
Publié le 12 oct 2014Lecture 9 min
Les cinq syndromes cardiorénaux
C. GUENANCIA, C. TINEL, J.-M. REBIBOU et Y. COTTIN, CHU Dijon
Les cinq syndromes cardiorénaux, décrits par Ronco en 2008(1), désignent les différentes interactions possibles entre insuffisance cardiaque et insuffisance rénale aiguë et chronique. Le cardiologue est aussi bien confronté à la prise en charge cardiovasculaire de patients atteints d’insuffisance rénale aiguë et surtout chronique qu’au dépistage et aux difficultés thérapeutiques des complications rénales de l’insuffisance cardiaque. Il est donc crucial de comprendre les mécanismes physiopathologiques impliqués pour orienter l’attitude diagnostique, thérapeutique et évaluer le pronostic des patients présentant un syndrome cardiorénal (SCR).
Type 1 : syndrome cardiorénal aigu
Il représente l’aggravation brutale de la fonction cardiaque (choc cardiogénique, acutisation d’une insuffisance cardiaque chronique) responsable d’une insuffisance rénale aiguë (IRA). De plus, la survenue d’une insuffisance rénale aiguë à l’occasion d’une décompensation cardiaque (25 à 45% des cas) est un facteur pronostique majeur de morbi-mortalité. En effet, dans la méta-analyse de Smith en 2005, la mortalité à 1 an après choc cardiogénique est de 38 % en cas de dysfonction rénale (DFG < 90 ml/min) et de 51 % si le DFG < 53 ml/min et seulement de 24 % en l’absence de dysfonction rénale. Il est également démontré que la présence d’un syndrome cardiorénal aigu augmente le nombre de passages en soins intensifs, la durée d’hospitalisation, nécessitent le recours à des traitements plus lourds et majore le risque de réhospitalisation.
La physiopathologie du SCR peut schématiquement être liée à deux mécanismes :
Tout d’abord une hypoperfusion et une hypofiltration rénales liées au bas débit cardiaque, ce qui va activer le système rénine-angiotensine, induisant une dilatation des artérioles afférentes et une vasoconstriction des artérioles efférentes. De plus, l’angiotensine stimule également la libération rénale d’endothéline I, vasoconstricteur pro-inflammatoire et profibrosant précipitant l’insuffisance rénale aiguë et son aggravation en nécrose tubulaire aiguë.
Cependant l’hypothèse de l’hypoperfusion par bas débit cardiaque ne peut expliquer l’insuffisance rénale aiguë dans les insuffisances cardiaques à fonction systolique conservée, d’autant que la majorité des patients hospitalisés présentant un syndrome cardiorénal sont en hypervolémie, dont beaucoup avec une fraction d’éjection ventriculaire gauche conservée. Cela peut être expliqué par le deuxième mécanisme impliqué : la stase rénale. En effet, l’hypervolémie est l’un des mécanismes de compensation dans l’évolution d’une insuffisance cardiaque chronique grâce à la régulation hydrosodée rénale, mais s’aggrave en cas d’ICA.
L’hypervolémie et l’augmentation des pressions dans les veines rénales sont responsables d’une stase rénale avec dysfonction tubulaire, rétention sodée aggravant l’hypervolémie et la vasoconstriction des artérioles afférentes conduisant à l’IRA.
Les voies thérapeutiques
Le traitement classique de l’insuffisance cardiaque aiguë repose sur les diurétiques, les dérivés nitrés, avec parfois le recours aux amines ou à l’ultrafiltration en cas de résistance aux diurétiques. Par ailleurs, certaines molécules semblent prometteuses, notamment le nésiritide (BNP de synthèse) qui altère la fonction rénale aux doses testées, mais semble au contraire l’améliorer à plus faible dose, avec des effets systémiques intéressants. L’étude ASCEND(2) actuellement en cours devrait permettre d’apporter des éclaircissements sur ces effets. L’autre voie prometteuse, les antagonistes de la vasopressine (Tolvaptan), qui améliorent à court terme l’état respiratoire et la perte de poids sans dégradation de la fonction rénale ou hyponatrémie, et surtout sans effets hémodynamiques délétères, offrant une alternative mieux tolérée aux dérivés nitrés.
Type 2 : syndrome cardiorénal chronique
Ce deuxième tableau concerne les anomalies cardiaques chroniques (insuffisance cardiaque chronique) conduisant progressivement à une insuffisance rénale chronique. La prévalence est extrêmement importante, en moyenne de 25% dans les grandes études.
La physiopathologie est identique au type 1, avec hypoperfusion et stase rénale, mais le retentissement rénal est plus durable par activation, via le SRA, de médiateurs pro-inflammatoires et profibrosants (endothéline) et d’une micro- et macroangiopathie délétère au niveau rénal comme cardiaque.
Par ailleurs, l’hypoperfusion induit également une hypoxémie rénale avec stress oxydatif et libération de TNF, IL1 et 6 à l’origine de l’apoptose des cellules rénales. Il faut aussi souligner le rôle central de l’anémie à la fois cause et conséquence du syndrome cardiorénal chronique, rôle longtemps sous-estimé. En effet, l’anémie est favorisée dans l’insuffisance cardiaque chronique par l’hémodilution, la malabsorption (œdème du tractus gastro-intestinal), un déficit en EPO non corrélé à l’insuffisance rénale et l’inhibition de l’hématopoïèse par les IL et TNF. Mais elle va également l’aggraver par une ischémie rénale et l’activation du SRA et de l’endothéline.
Les voies thérapeutiques
La plupart des études excluant les patients atteints d’un syndrome cardiorénal de type 2, nous ne disposons pas de traitements ayant fait leurs preuves dans cette pathologie.
Néanmoins, les recommandations de l’ESC(3) privilégient l’association aux diurétiques de l’anse des diurétiques thiazidiques ou antialdostérones, et les inhibiteurs de l’enzyme de conversion. Mais ces derniers sont trop souvent arrêtés ou non prescrits devant l’insuffisance rénale, alors qu’il n’y a pas de seuil de créatinine contre-indiquant la prescription et que la seule contre-indication rénale formelle est la sténose bilatérale des artères rénales ou sur rein unique.
Enfin, si la dialyse est le traitement de suppléance de l’insuffisance rénale terminale, la dialyse péritonéale peut trouver une indication bien particulière dans les insuffisances cardiaques chroniques réfractaires au traitement médicamenteux : elle améliore la qualité de vie des patients sans toutefois avoir montré de bénéfice en termes de mortalité.
Type 3 : syndrome rénocardiaque aigu
Ce troisième tableau inclut une aggravation brutale de la fonction rénale (IRA ischémique, glomérulonéphrite), responsable d’une pathologie cardiaque aiguë (ICA, arythmie, ischémie).
La prévalence des décompensations cardiaques aiguës secondaires à une insuffisance rénale aiguë (IRA) est difficile à déterminer. En effet, ces patients présentent des facteurs de risque et des antécédents cardiaques extrêmement hétérogènes, et par ailleurs, cela suppose de définir un seuil d’IRA consensuel.
Une hypervolémie dans un contexte d’IRA peut entraîner un œdème aigu du poumon, mais les mécanismes physiopathologiques ne se résument pas cependant à la simple surcharge hydrosodée. En effet, les glomérulonéphrites aiguës, par exemple, s’accompagnent volontiers d’hypertension artérielle sévère ; à l’élévation de la précharge s’ajoute donc celle de la postcharge, pour au final augmenter fortement le travail cardiaque et potentiellement induire une ICA. De plus, l’IRA s’accompagne fréquemment de désordres hydro-électrolytiques qui sont source d’arythmies soit d’emblée, soit lors de leur correction (par exemple, passage en fibrillation auriculaire lors de la correction rapide d’une hyperkaliémie par l’épuration extra-rénale). Par ailleurs, l’activation du SRAA au cours de l’IRA va permettre le maintien d’une pression de perfusion rénale, mais au prix d’une vasoconstriction systémique majeure, pouvant être responsable d’une souffrance coronaire chez les patients prédisposés. Enfin, comme dans le syndrome cardiorénal aigu, la souffrance des cellules rénales va induire une libération de cytokines pro-inflammatoires et une activation des monocytes jusqu’à l’activation de la cascade des caspases et la mort de cellules endothéliales et myocardiques.
Les voies thérapeutiques
La prévention est essentielle et permet de manière simple d’éviter de lourdes complications, en particulier l’IRA liée aux produits de contraste iodés. En effet s’ils n’ont aucune toxicité cardiaque directe, ils peuvent induire une nécrose tubulaire aiguë et secondairement une rétention hydrosodée conduisant à la décompensation cardiaque. De plus, ces patients ont deux fois plus de risque de présenter des effets indésirables, notamment cardiovasculaires, dans l’année qui suit l’exposition aux produits de contraste.
À l’heure actuelle, la prévention par hydratation avec du sérum salé isotonique est la mesure qui a montré la plus grande efficacité.
Enfin, un management adéquat de l’IRA en termes de maîtrise de la volémie, d’équilibre hydroélectrolytique et d’épuration des toxines urémiques reste la meilleure prévention du syndrome cardiorénal de type 3.
Type 4 : syndrome rénocardiaque chronique
L’insuffisance rénale chronique contribue à une dégradation de la fonction cardiaque, à une hypertrophie cardiaque et/ou à un risque accru d’événements cardiovasculaires.
Une méta-analyse récente(4) a montré une relation exponentielle entre la sévérité de la maladie rénale et le risque de mortalité toutes causes confondues, dont plus de 50% de mortalité de cause cardiovasculaire. Ces données viennent corréler ce que les registres de patients dialysés avaient déjà mis en évidence : 80% des patients présentent une hypertrophie ventriculaire gauche (HVG) à l’initiation de la dialyse, 50% développeront une coronaropathie asymptomatique, et les décès cardiovasculaires sont 10 à 20 fois plus élevés que dans la population générale.
La physiopathologie est complexe, et au préalable il convient de rappeler qu’IRC et ICC ont des facteurs de risque communs et surviennent volontiers chez les patients âgés, diabétiques et hypertendus. Les mécanismes déjà évoqués dans le syndrome cardiorénal de type 3, quand ils se prolongent chez le patient insuffisant rénal chronique, vont contribuer à la dégradation de la fonction cardiaque : surcharge hydrosodée, troubles électrolytiques et accumulation de toxines urémiques.
L’HVG est précoce dans l’IRC, probablement dès 60 ml/min de clairance de la créatinine, et sa physiopathologie est mixte. L’HVG excentrique est liée à la surcharge hydrosodée avec augmentation de la précharge, distension du VG et ajout de nouveaux sarcomères en série ; elle est responsable d’une dysfonction diastolique. L’existence d’une fistule artério-veineuse de dialyse et l’anémie peuvent encore aggraver l’augmentation de volume. L’HVG concentrique, quant à elle, est due à une augmentation de la pression systolique : HTA, artériosclérose, sténose aortique. Les sarcomères vont s’additionner en parallèle et venir épaissir la paroi du VG. Au total, ce remodelage du VG va favoriser l’apparition de troubles du rythme et diminuer la réserve coronaire.
En miroir de ce qui se passe pour le cœur, le système vasculaire de l’insuffisant rénal est dilaté, épaissi et rigide. De plus, les troubles du métabolisme minéralo-calcique vont également contribuer à la calcification des vaisseaux, notamment coronaires et des tissus mous. Parallèlement, l’accumulation des guanidines, petites molécules urémiques, a montré sa corrélation avec l’épaisseur de l’intima et de la media.
Enfin, il existe fréquemment chez ces patients un état d’inflammation chronique (infection, bio-incompatibilité de la dialyse) responsable d’un stress oxydatif et accélérant les processus d’athérome.
Les voies thérapeutiques
Prévenir l’IRC et sa progression est le meilleur moyen de prévenir les complications cardiovasculaires qui lui sont inhérentes. Parmi les thérapeutiques, les bêtabloquants et les inhibiteurs du SRA ont des indications larges, mais semblent paradoxalement insuffisamment utilisés chez les patients dialysés, alors même que leur imputabilité dans les hypotensions perdialytiques n’a pu être démontrée. Les chélateurs non calciques du phosphore et les calcimimétiques en luttant contre l’hyperparathyroïdie ont un rôle central dans la prévention des calcifications vasculaires. L’anémie par son rôle prépondérant est une cible majeure du traitement. La correction de l’anémie permet en partie de réduire la masse du VG sans cependant revenir à la normale. Ainsi le recours aux agents stimulants l’érythropoïèse doit être précoce avant que ne surviennent des complications irréversibles.
Type 5 : pathologie systémique responsable d'une dysfonction cardiaque et rénale
Dans ce sous-type, la défaillance cardiaque et rénale est secondaire à une pathologie systémique, qu’elle soit aiguë ou chronique. Ce concept regroupe potentiellement des pathologies très variées, allant du diabète au sepsis. Et il est ainsi difficile d’en évaluer la prévalence. Le meilleur traitement est étiologique, même s’il faut fréquemment recourir aux traitements symptomatiques de ces défaillances pour contrôler leur phase aiguë.
En conclusion
La nouvelle classification proposée par Ronco permet une meilleure approche physiopathologique, thérapeutique et pronostique des syndromes cardiorénaux.
La thérapeutique étant limitée pour le moment du fait d’interactions neurohormonales complexes, il est essentiel pour le clinicien, néphrologue ou cardiologue, de dépister précocement et de prévenir l’apparition de ces défaillances secondaires qui, une fois installées, diminuent la qualité de vie et entraînent une surmortalité majeure, et justifient probablement une surveillance plus rapprochée.
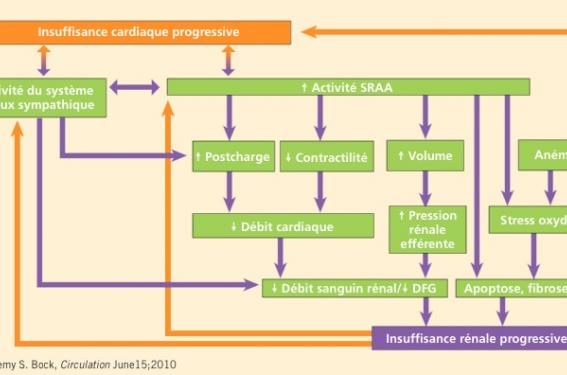
Figure 1. Relation entre insuffisance cardiaque et insuffisance rénale.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :