Publié le 30 sep 2016Lecture 9 min
Le traitement médical de l’anévrisme de l’aorte abdominale
V. ABOYANS, Service de cardiologie, CHU de Limoges
L’anévrisme de l’aorte abdominale (AAA) est de nos jours le plus souvent retrouvé à un stade précoce, avant l’heure d’une intervention (endovasculaire ou chirurgicale). Il est mis en évidence par une imagerie abdominale, soit de manière fortuite, ou lors d’une échographie de dépistage. Si la prise en charge interventionnelle est bien codifiée, le traitement médical est encore flou et mal appliqué.
Le dépistage
Depuis 4 essais réalisés dans les années 90, nous avons la preuve que le dépistage de l’AAA (défini par un diamètre de plus de 30 mm) chez les hommes de plus de 65 ans, permet de réduire la mortalité liée à cette lésion de -45 % et réduit même la mortalité totale de 2 %(1). Suite à ces essais, le dépistage ultrasonore de l’AAA est recommandé dans cette population (tableau)(2) et dans certains pays, notamment en Grande-Bretagne, une campagne de dépistage de masse est mise en route. Paradoxalement, aucune campagne nationale de dépistage systématique n’est mise en place dans notre pays.
a. Classification des grades de recomm andations de l’ESC : I – la procédure est utile et efficace : doit être fa ite, IIa – l esdonnées ou avis sont contradictoires mais en faveur d’un intérêt ou efficacité : doit être considéré, IIb – les données/avissont contradictoires et l’intérêt/bénéfice est moins établi : peut être considéré, III – les données/avis concordent sur l’inefficacité(ou nocivité) : ne doit pas être fait.b. Niveaux de preuve : A – Données issues de nombreux essais randomisés ou méta-analyses, B – Données issues d’unseul essai randomisé ou des grandes études non randomisées, C – avis d’experts et/ou données issues de petites études,
études rétrospectives, registres.
En attendant, il est recommandé pour les cardiologues pratiquant l’échocardiographie de terminer l’examen de leurs patients à risque par un dépistage opportuniste de l’AAA (tableau)(2).
L’autre paradoxe de ce dépistage (comparé par exemple à d’autres dépistages tels que celui des cancers) est la prise en charge proposée des lésions retrouvées (figure 1). En effet, à l’heure actuelle, dans la majorité des cas détectés (c’est-à-dire en cas d’AAA < 50-55 mm), une solution de « wait and see » est proposée. Cette solution attentiste consiste à surveiller régulièrement ces lésions à intervalles codifiés(2) en attendant l’heure de l’intervention, sans aucune intervention médicale pour modifier le cours de l’histoire naturelle de la maladie.
Idéalement, la stratégie de dépistage d’une lésion doit être suivie d’une intervention médicale afin de ralentir la progression ou éradiquer la maladie, et in fine améliorer le pronostic général du patient. Dans cet article, nous allons faire le point sur l’état des connaissances des interventions médicales proposées pour ralentir la progression de l’AAA. Il est à rappeler que les essais comparant une intervention (endovasculaire ou chirurgicale) à une simple surveillance des AAA < 55 mm n’ont pas retrouvé de différences de mortalité, justifiant la stratégie « médicale »(3,4).
Figure 1. Le paradoxe du dépistage des AAA (d’après Guessous et al. 2008). A. Schéma habituel lors d’un dépistage (ex. : cancer de côlon) : le dépistage permet d’améliorer le pronostic des patients notamment lors de la découverte d’une petite lésion, avec intervention efficace. B. La situation actuelle du dépistage d’AAA : seules les plus grosses lésions (beaucoup plus rares) sont orientées vers une « intervention efficace » c’est-àdire améliorant le pronostic. C. La situation idéale serait non seulement d’intervenir sur les gros anévrismes mais également ralentir la progression des petits AAA.
Facteurs de risque de l’AAA
Les trois facteurs de risque le plus fortement associés à la présence d’AAA sont l’âge, le tabagisme et les antécédents familiaux d’anévrisme. La coexistence d’une maladie athéromateuse (par exemple une AOMI), l’HTA et la dyslipidémie sont également d’autres facteurs associés. Les femmes, les sujets d’origine africaine et les diabétiques sont les populations à plus faible risque d’AAA(5).
Facteurs de progression de l’AAA
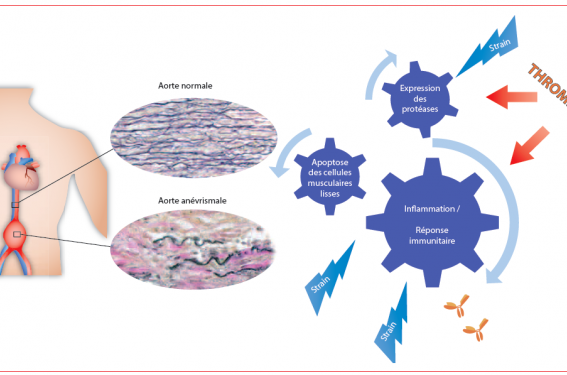
La physiopathologie de la progression de l’AAA est complexe et varie probablement d’un individu à un autre. Elle combine essentiellement (figure 2) : une raréfaction des cellules musculaires lisses (phénomène d’apoptose), une surexpression des enzymes protéolytiques et une activation de l’inflammation et des systèmes immunitaires. Ces trois phénomènes sont interdépendants, potentialisés par le stress mécanique de la paroi et la thrombose du sac anévrismal, pouvant être soustendus par le génotype du patient.
Sur le plan épidémiologique, les facteurs de risque associés à la progression d’un petit AAA suivi médicalement sont la poursuite de tabagisme, la taille initiale de l’AAA retrouvée, ainsi que la pression pulsée(6). Les facteurs de risque associés à la rupture de l’AAA sont encore l’âge, la poursuite du tabagisme, mais aussi la pression artérielle (moyenne et pulsée), en sachant qu’à diamètre égal, le risque de rupture est plus important chez la femme(6).
Figure 2. Physiopathologie de la croissance d’AAA.
Comment ralentir la progression d’un AAA ?
L’arrêt du tabac
Le tabagisme étant le facteur le plus puissant de survenue, de progression et de rupture d’AAA, l’arrêt de celui-ci est la meilleure « intervention » connue pour freiner son évolution. Il n’y a pas d’essai randomisé sur ce sujet, mais l’étude de l’évolution des AAA chez les fumeur s montre que cette lésion progresse 2 fois moins vite lorsque le tabagisme est arrêté lors du diagnostic(7). Il est non seulement impératif d’expliquer au patient (image d’AAA à l’appui) et de le conseiller, mais également d’augmenter les chances du sevrage par la prescription de traitement adapté et de suivi tabacologique.
L’activité physique ?
L’activité physique est parfois à tort contre-indiquée chez les porteurs d’AAA. Une étude randomisée incluant 140 porteurs d’AAA < 55 mm a comparé une réadaptation physique (en centre ou à domicile, avec trois séances hebdomadaires de tapis roulant, cycloergomètre ou rameur, ayant pour objectif de dépenser > 1 000 cal/semaine, avec une FC max à 60 % de la FMT) à la stratégie de suivi habituel(8). Les patients avaient en moyenne 70 ans et étaient suivis durant 2 ans. Les capacités physiques étaient nettement améliorées dans le bras « exercice », sans aucune complication concernant les AAA, ni différence en termes de progression anévrismale. Si l’exercice physique ne modifie pas l’histoire naturelle des petits AAA, il améliore les conditions physiques des patients avec un intérêt pronostique à long terme chez ces patients à risque cardiovasculaire, mieux préparés, notamment s’ils doivent bénéficier d’une intervention chirurgicale. Il reste néanmoins prudent de déconseiller les exercices ou efforts isométriques.
Approches pharmacologiques
• Des travaux expérimentaux ont démontré que le diamètre de l’AAA augmente plus vite lors d’un stress de paroi plus important. Ce stress favorise l’inflammation et l’activité protéolytique dans la paroi de l’anévrisme(9).
Les bêtabloquants sont connus pour ralentir les complications de l’aorte thoracique chez les sujets atteints d’un syndrome de Marfan.
Par extrapolation ces traitements ont été souvent proposés en cas d’AAA. Une méta - analyse a étudié l’ensemble des travaux à ce sujet(10). Si les études observationnelles sont en faveur d’une moindre progression de l’anévrisme chez les patients sous bêtabloquants, les essais thérapeutiques, utilisant le propanolol, ont été négatifs. Compte tenu de ses propriétés spécifiques, le nébivolol pourrait être intéressant mais n’a fait l’objet d’aucune évaluation sérieuse dans ce domaine.
• Le système rénine-angiotensine semble être impliqué dans la physiopathologie des AAA. Dans un modèle animal, l’infusion d’angiotensine-II mène au développement d’AAA(11), et le recours aux sartans limite la progression du diamètre aortique abdominal. Dans une étude observationnelle chez des hypertendus ayant eu une échographie aortique, ceux étant sous ARA 2 ou IEC avaient des diamètres aortiques plus faibles que ceux ayant d’autres antihypertenseurs, et une échographie à distance montrait un élargissement moindre sous ces 2 classes thérapeutiques(12). Une autre étude, s’intéressant à l’ensemble des patients > 65 ans hospitalisés dans l’état d’Ontario pour AAA, retrouve une plus faible proportion d’AAA rompus chez ceux sous IEC (-8 %, p significatif)(13). De même, dans la base des assurés au Danemark, la mortalité liée aux AAA était moindre chez les patients traités par IEC/ARA 2(14). À l’inverse, les études de suivi échographique des AAA dépistés ne trouvent pas de ralentissement d’expansion sous IEC/ARA 2, et même une des plus grandes études (essai UKSAT) a trouvé une plus forte expansion sous IEC(15). Ces données contradictoires soulignent les limites des études observationnelles. Actuellement, l’essai randomisé TEDY compare le telmisartan 40 mg au placebo, mais les résultats sont en attente(16).
• Au-delà de leur effet hypolipémiant, les statines ont d’autres effets potentiellement intéressants pour limiter la progression d’un AAA, notamment via l’inhibition du facteur nucléaire κB induite par la TNFα, et la réduction de la sécrétion de métalloprotéases (MMP-9)(17). Une métaanalyse de 7 études de bonne qualité est en faveur d’un ralentissement de progression des AAA(18). Toujours dans la base de données nationale au Danemark, la probabilité de rupture était plus faible chez les porteurs d’AAA sous statines(19). De même, parmi ceux hospitalisés pour rupture d’AAA, la survie était meilleure chez les porteurs d’AAA (-24 % de décès toutes causes). Un véritable essai de grande envergure serait a priori nécessaire, mais éthiquement difficile car la grande majorité des patients porteurs d’AAA ont par ailleurs une indication pour les statines (nous y reviendrons). Chez ces patients, les statines seraient d’autant plus intéressantes qu’une étude hollandaise rapporte une meilleure survie des patients ayant eu une intervention pour AAA sous statines(21).
• La présence et l’importance du thrombus mural étant associées à la progression d’AAA(20), il est légitime de penser qu’un traitement antithrombotique puisse limiter l’expansion de l’anévrisme. Dans une seule étude observationnelle incluant 148 patients porteurs d’AAA de 30 à 48 mm, la prise d’aspirine était associée à une réduction du risque de recours à une intervention, seulement chez ceux ayant les plus gros AAA de 40-48 mm, a priori plus à risque de thrombose(22). Là encore, aucun essai thérapeutique n’est disponible. On peut légitimement s’interroger sur le risque hémorragique en cas de rupture.
• Certaines infections chroniques (par ex. Chlamydiae) pourraient avoir un rôle dans le développement des AAA. Deux essais randomisés (au total 170 sujets) testant la roxithromycine (durant 4 semaines) rapportent une diminution du taux d’expansion des anévrismes. Aucun essai de grande envergure n’est encore disponible. Des hypothèses semblables avaient été proposées pour le recours à la doxycycline, mais un essai récent de bonne qualité était négatif(23). Un autre essai avec l’azithromycine a également été négatif.
• D’autres molécules ayant des effets sur les différentes composantes de l’inflammation observées dans la paroi anévrismale ont été testées. Un essai avec le pémirolast, un inhibiteur des mastocytes, n’a pas démontré de différences de progression d’AAA(24). Après des essais concluants chez l’animal, les effets de la ciclosporine chez les porteurs d’AAA sont en attente.
En pratique
En dehors du sevrage tabagique, nous avons encore peu de preuves intangibles quant à l’intérêt d’un traitement médical à ralentir la progression des AAA. Cependant ces patients sont à haut risque cardiovasculaire, et décéderont 20 fois plus souvent d’un accident cardiaque ou cérébral plutôt que par rupture d’anévrisme(25).
De ce point de vue, le contrôle des facteurs de risque et le recours aux traitements ayant un bénéfice en prévention primaire (statines, IEC/ARA 2) semble légitime, et explique d’ailleurs les difficultés d’ordre éthique à mettre en place un essai d’envergure avec ces traitements, puisque souvent les porteurs d’AAA ont des facteurs de risque ou des comorbidités cardiovasculaires justifiant le recours à ces traitements. Pour rappel, l’ESC recommande le recours aux statines et IEC (recommandation IIb, niveau B) chez ces patients.
Références sur demande à la rédaction : biblio@axis-sante.com
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :