Chirurgie
Publié le 31 oct 2016Lecture 6 min
ESC 2016 : « Le regard du chirurgien »
J.-F. OBADIA ,Hôpital Louis Pradel, Lyon
Lors du récent ESC à Rome, la Heart Team était à l’honneur avec de nombreuses thématiques médico-chirurgicales. Une session organisée par le « surgical working group » de l’ESC faisait salle comble sur l’ensemble de la journée du samedi. Plusieurs autres sessions insistaient sur la complémentarité médico-chirurgicale avec plusieurs messages forts :
• Si l’angioplastie est aujourd’hui devenue la technique de revascularisation coronaire princeps, la chirurgie reste supérieure chez les coronariens les plus sévères, en particulier si on prend la peine d’évaluer les résultats au-delà de la 1re ou 2e année.
• Les recommandations 2016 sur la fibrillation atriale précisent la place de la chirurgie qui ne figurait pas dans les précédentes recommandations de 2012.
• Les procédures TAVI sont de plus en plus fiables avec une morbi-mortalité post-procédure en diminution. Elles prennent donc logiquement une place croissante chez les patients âgés. Néanmoins, ces bioprothèses doivent être sévèrement contraintes pour être introduites dans le cathéter porteur, ce qui pourrait expliquer les dégénérescences précoces qui ont été rapportées. Sans remettre en cause la qualité des résultats à court et moyen terme, la faible durabilité pourrait ainsi représenter le talon d’Achille de cette technique. Dans l’attente d’études échographiques longitudinales solides, la prudence est requise avant d’abaisser l’âge d’implantation.
• La chirurgie réparatrice mitrale pour l’IM primaire a été l’objet d’une belle session jointe « ESC-ACC/AHA » d’où l’on retiendra la nécessité d’une prise en charge par une Valve Team incluant bien sûr une expertise en chirurgie réparatrice mais aussi un « Corelab echo » spécialisé. La tendance à opérer les IM primaires plus tôt, chez des patients asymptomatiques, impose une exigence sur la qualité des indications et des résultats avec une place croissante pour la chirurgie mini-invasive (figure 1).
• La prise en charge des IM secondaires est un domaine en pleine mutation avec des indications chirurgicales de faible niveau de preuve et l’arrivée de procédures percutanées aussi prometteuses qu’incertaines. C’est ce domaine que nous avons choisi de développer ci-après.
Figure 1. Réparation mitrale chez un patient asymptomatique avec IM primaire (incision périmamelonnaire pour le geste mitral sous vidéoscopie + circulation extracorporelle percutanée).
Prise en charge des insuffisances mitrales secondaires
Les IM secondaires (IMS) à une déchéance myocardique (2/3 d’ischémique et 1/3 dilatées) ont un pronostic très sombre (environ 30 % de survie à 5 ans pour les IM sévères). La nécessité de les corriger et les techniques proposées restent l’objet d’une vive controverse dont nous résumons l’histoire.
Braunwald versus Bowling
Longtemps, l’hypothèse de E. Braunwald, « effet soupape protecteur », a poussé à respecter ces IMS jusqu’à ce que S. Bowling soutienne une hypothèse inverse « l’IM aggrave et entretient la dysfonction VG », sa correction chirurgicale par une annuloplastie de réduction doit réorienter favorablement la fonction VG. Les résultats de cette chirurgie ont montré une morbi-mortalité peropératoire finalement faible pour cette population sévère (1,6 à 8 %) mais avec un taux de récidive de la fuite problématique à distance (figure 2).
Figure 2. Récidive des fuites mitrales après chirurgie réparatrice des IM secondaires dans la littérature. D’après Magne et al. Cardiology 2009 ; 112 : 244.
Jusqu’où réparer les IMS selon A. Calafiore
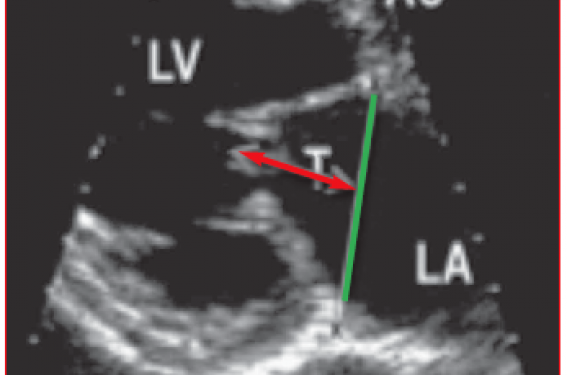
Ce taux prohibitif de récidive des fuites mitrales est lié à une traction excessive sur les cordages mitraux. A. Calafiore propose un seuil de moins de 10 mm pour la hauteur de la tente (figure 3) pour accepter de réparer les IMS, au-delà il est préférable de remplacer la valve mitrale.
Figure 3. La hauteur entre le plan de l’anneau et le point de coaptation définit les possibilités de réparation valvulaire des IMS. D’après Calafiore. Ann Thorac Surg 2004 ; 77 : 1 989-97.
Jusqu’où opérer les IMS selon R. Dion
Lorsque les VG sont trop dégradés et dilatés, R. Dion montre que la survie après chirurgie des IMS est prohibitive avec une limite à 65 mm pour le diamètre télédiastolique et 51 mm pour le diamètre télésystolique (figure 4).
Figure 4. Au-delà de 65 mm de diamètre télédiastolique (LVEDD), la chirurgie de l’IMS est grevée d’un risque prohibitif. D’après Dion et al. Eur J Cardiothorac Surg 2005 ; 27 : 847-53.
Technique d’Alfieri
Cette technique créant un double orifice mitral a longtemps été décriée car antianatomique. Les résultats excellents à long terme (18 ans) ont balayé les réticences initiales et cette technique est aujourd’hui validée avec même un bénéfice particulier pour les IMS (figure 5). Elle sert de modèle aux techniques percutanées comme le MitraClip.
Figure 5. La qualité de la réparation mitrale après chirurgie de l’IMS est plus durable dans un groupe ayant reçu un geste d’Alfieri en plus de l’annuloplastie de réduction que dans le groupe avec annuloplastie seule. D’après De Bonis et al. Circulation 2005.
MitraClip
Cette technique reproduit en partie la technique d’Alfieri en créant un double orifice mitral mais sans annuloplastie, ce qui en limite l’efficacité avec un taux d’IM résiduelle significatif. Seule étude prospective randomisée, « Everest II » dans le traitement des IM primaires et secondaires montre une bonne sécurité avec, en particulier, moins de transfusion dans le groupe MitraClip mais une déception à court terme (20 % de réopérations à 1 an dans le groupe MitraClip versus 2 % dans le groupe chirurgie). Aujourd’hui le MitraClip s’adresse le plus souvent aux IMS avec des études de cohorte encourageantes mais un niveau de preuve faible et on attend les résultats des 3 études prospectives randomisées en cours, et en particulier l’étude Mitra.fr en France.
Il est trop tôt pour donner des recommandations solides sur les indications de MitraClip qui ont comme principale faiblesse l’absence d’annuloplastie associée et un taux d’IM résiduelle et a fortiori récidivante non négligeable.
Récemment, l’équipe d’Alfieri montre (figure 6) qu’un résultat immédiat imparfait (IM résiduelle grade 2) présent dans 28,7 % des patients a un impact négatif sur le taux de récidive et sur la mortalité, ce qui pousse à développer des techniques d’annuloplastie percutanée pour tenter de reproduire la technique chirurgicale originelle complète.
Figure 6. Après mise en place d’un MitraClip, un résultat imparfait (28,7 % des cas) impacte négativement le pronostic.
Annuloplastie percutanée
Après plus de 30 ans d’expérience chirurgicale, l’annuloplastie s’est imposée comme un pilier incontournable de la « French Correction » décrite par Alain Carpentier. Plusieurs techniques d’annuloplastie percutanée tentent de répondre à cette exigence. Après l’échec des procédures indirectes utilisant le sinus coronaire, la technique Cardioband-Valtech en cours de développement est un bon candidat pour assurer une annuloplastie efficace (figure 7). Cette annuloplastie directe avec vissage percutané de l’anneau prothétique reproduit le geste chirurgical. Les obstacles techniques restent encore importants même si les premiers résultats semblent encourageants (une cinquantaine d’implantations humaines aujourd’hui).
Figure 7. Lorsque la procédure Cardioband est menée à son terme sans encombre (geste encore très délicat), le résultat obtenu est comparable à une annuloplastie chirurgicale.
Réparation ou prothèse ?
Quelle que soit la technique de réparation, annuloplastie isolée ou complétée par un geste additionnel, chirurgical ou a fortiori percutané, le taux élevé de récurrence de la fuite a conduit à proposer une étude chirurgicale prospective randomisée comparant réparation et remplacement prothétique biologique et montré une survie équivalente (figure 8). Toutefois, le taux de récidive de la fuite était plus important dans le groupe réparation 32,6 % que dans le groupe remplacement.
Cette étude a néanmoins comparé des IMS sans distinction de la forme anatomique ce qui ne serait guère acceptable au sein d’une valve team connaissant bien les limites des indications de réparations dans l’IMS. En effet, les analyses en sousgroupes montrent une mortalité moins élevée et un meilleur devenir dans les formes anatomiques favorables (NS). La réparation qui contrairement aux remplacements préserve l’appareil sous-valvulaire (particulièrement important en cas de dysfonction VG) reste une option qui doit être privilégiée même si cette étude a au moins le mérite d’en montrer les limites.
Figure 8. Étude randomisée prospective comparant réparation et remplacement dans l’IMS.
En pratique
Si nous avons aujourd’hui de nombreuses preuves de la gravité des IMS dans l’évolution des cardiomyopathies dilatées ou ischémiques, leur prise en charge laisse deux questions majeures sans réponses claires :
• Faut-il corriger les IMS ? Les recommandations européennes sont pour le moins pusillanimes. La seule indication reconnue en dehors des gestes associés à une revascularisation coronaire est de grade IIb (niveau de preuve C) chez les patients symptomatiques malgré un traitement médical optimal et avec une FE > 30 %. Compte tenu des études publiées depuis ces recommandations, les indications devraient être plus larges afin de ne pas attendre que les VG soient complètement dégradés chez des patients NYHA III ou IV ayant déjà fait plusieurs épisodes de décompensation à un stade où toute prise en charge est dépassée.
• Quelle technique pour corriger l’IM ? Les éléments permettant de choisir une réparation ou un remplacement sont mieux connus, reposant principalement sur l’échographie (figure 9). Le respect de ces règles devrait autoriser de meilleurs résultats face à une pathologie qui reste un challenge compte tenu de son très mauvais pronostic. Le MitraClip pourrait trouver une place chez les patients contre-indiqués à la chirurgie. Sa place sera mieux précisée par les études en cours.
Dans tous les cas, ces patients complexes seront mieux pris en charge par une valve team dans une équipe pouvant offrir à ses patients toutes les techniques à disposition depuis la sternotomie jusqu’aux procédures percutanées innovantes en passant par la chirurgie mini-invasive.
Figure 9. Critères échographiques définissant les limites au-delà desquelles une réparation est à haut risque de fuite résiduelle, conduisant à préférer un remplacement prothétique.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :