Publié le 15 déc 2016Lecture 6 min
Ventricule gauche non compacté ou non-compaction isolée du ventricule gauche - Que retenir ?
E. DONAL, CHU de Rennes
La non-compaction isolée du ventricule gauche (NCVG) est une cause rare de cardiomyopathie supposée résulter de l’arrêt de l’embryogenèse normale du myocarde, et caractérisée par la persistance de trabéculations ventriculaires proéminentes séparées par des récessus profonds.
Faut-il distinguer la NCVG des autres cardiomyopathies dilatées ? Faudra-t-il distinguer des formes à pronostic différent de NCVG ?
De nombreux cas de NCVG familiales plaident en faveur d’une origine génétique de la maladie. Un travail français piloté par G. Habib (AP-HM, Hôpital La Timone, Marseille) s’est intéressé à cette problématique de l’apport de la génétique pour le diagnostic et la prise en charge des NCVG. Des résultats devraient très prochainement être connus.
D’ores et déjà, des travaux ont montré par exemple, que des patients bradycardes (avec dysfonction sinusale) pouvaient avoir des non-compactions ventriculaire gauche mais aussi ventriculaire droite. Ceux-ci n’ont pas une cardiopathie arythmogène du ventricule droit mais une mutation du gène du canal HCN4 et donc une authentique cardiomyopathie dont la morphologie est frappante par la non-compaction et l’hypertrabéculation des deux ventricules. Initialement considérée comme une cardiopathie très sévère du sujet jeune, responsable d’une mortalité élevée par insuffisance cardiaque, les séries les plus récentes ont montré que la NCVG pouvait être associée à un pronostic favorable dans un grand nombre de cas et pouvait s’observer à tout âge.
L’imagerie joue un rôle fondamental dans le diagnostic et l’évaluation des NCVG
La principale caractéristique anatomique de la NCVG est l’existence de trabéculations ventriculaires myocardiques nombreuses et profondes, en général localisées au niveau de l’apex du ventricule gauche (VG). Bien que de nombreux critères diagnostiques aient été proposés, à l’échographie comme à l’IRM, l’échocardiographie est l’examen clé qui en permet le diagnostic, en montrant les critères qui permettent de la suspecter. La définition elle-même de la NCVG reste cependant débattue, puisque 3 définitions échographiques et 2 définitions IRM différentes existent, toutes basées sur un très faible nombre de corrélations anatomiques et pouvant finalement donner un diagnostic différent chez le même patient.
Critères échocardiographiques et IRM permettant de suspecter une NCVG (figures 1 et 2) :
- présence de trabéculations VG multiples ;
- présence de récessus profonds intertrabéculaires ;
- flux Doppler couleur à l’intérieur des récessus et en communication avec la cavité VG ;
- absence de cardiopathie associée ;
- classiquement, le diagnostic de NCVG est retenu lorsque le rapport zone non compactée/zone compactée est supérieur à 2 en systole et en petit axe.
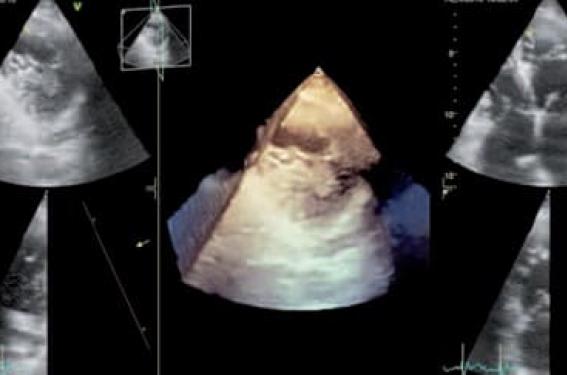
Figure 1. Mesure en diastole et en parasternal petit axe de l’épaisseur non compactée/épaisseur compactée (épicardique). Ici franches trabéculations, non-compaction touchant tout l’apex en particulier en inférolatéral. Intérêt du 3D pour mieux distinguer les trabéculations.
Figure 2. Vue apicale avec image 2D et image 2D couleur. Celle-ci permet de montrer le remplissage des trabéculations par le Doppler couleur.
Diagnostic
Le diagnostic de NCVG n’est donc pas si aisé qu’il pourrait y paraître. Il nécessite le plus souvent une approche d’imagerie multimodalités (figure 3). L’échocardiographie, le scanner et l’IRM cardiaque sont les examens de référence pour le diagnostic de NCVG. Le diagnostic est facile dans les formes typiques, caractérisées par des trabéculations larges séparées par des récessus profonds inter-trabéculaires. La localisation de la zone non compactée est caractéristique, prédominant à l’apex et sur les segments latéro-médians et inféro-médians. Dans les cas douteux, il est très important de s’aider du Doppler couleur (éventuellement du Sonovue pour opacification de la cavité ventriculaire), afin de bien obtenir un critère diagnostique important qui est la visualisation d’un remplissage des espaces intertrabéculaires par le flux sanguin provenant de la cavité ventriculaire. La fonction VG est souvent altérée, bien qu’une fraction d’éjection normale puisse être observée chez les patients atteints de NCVG (ou les apparentés).
Figure 3. Images des trabéculations en IRM et en échocardiographie.
Scanner et IRM cardiaques
Le scanner cardiaque et surtout l’IRM cardiaque doivent être pratiqués en complément de l’échocardiographie, surtout en cas d’échographie douteuse. L’IRM présente l’avantage d’un meilleur rapport signal sur bruit que l’échocardiographie, mais l’inconvénient d’une plus faible disponibilité. Quelle que soit la méthode diagnostique utilisée, le diagnostic de NCVG est cependant parfois difficile : la principale difficulté, en échographie comme en IRM, est de différencier une hypertrabéculation « physiologique » observée fréquemment dans certaines cardiomyopathies primitives, certaines ethnies et suite à des activités sportives intenses, des réelles non-compactions. Le diagnostic de NCVG peut également être difficile dans les formes localisées.
Il ne faudra pas oublier le mot : « isolé ». Ceci signifie que pour retenir le diagnostic de NCVG, il aura au préalable été écarté la coronaropathie, en particulier le post-infarctus, mais aussi, une valvulopathie, en particulier une régurgitation aortique.
Conséquences thérapeutiques
Concernant, les conséquences thérapeutiques du diagnostic de NCVG : le traitement est identique à celui des autres cardiomyopathies dilatées. Dans l’état actuel de nos connaissances, il n’y a pas d’argument pour traiter différemment les patients porteurs d’une NCVG, notamment en termes de traitement anticoagulant ou de prévention des complications rythmiques. Le traitement anticoagulant est conseillé par certains en cas de dysfonction VG avec fraction d’éjection < 40 % (en particulier, lorsqu’il y a eu un événement embolique documenté). Les indications de mise en place d’un défibrillateur implantable obéissent aux recommandations habituelles de prise en charge des cardiomyopathies.
Bien que la NCVG soit réputée de plus mauvais pronostic que les autres formes de cardiomyopathies, son évolution est très variable et en fait mal connue. Si la NCVG s’accompagne classiquement d’un risque embolique et rythmique élevé, il existe sans doute un spectre assez large d’expression clinique de cette cardiomyopathie comme des autres cardiomyopathies telles les cardiomyopathies hypertrophiques sarcomériques qui peuvent être très sévères ou totalement asymptomatiques chez deux membres d’une même famille ayant la même mutation.
La valeur pronostique de l’échocardiographie est probable mais nécessite des investigations complémentaires. Des travaux récents insistent sur le rôle potentiel du 2D strain longitudinal avec une répartition des déformations régionales très caractéristiques du NCVG (figure 4).
Figure 4. Aspect en cocarde avec strain longitudinal préservé dans les territoires non compactés.
Surveillance et dépistage familial
Elles sont identiques à celles des autres CMD : examen clinique par un cardiologue au minimum une fois par an, de manière plus rapprochée en cas de nouveaux symptômes ou de nécessité d’ajustements thérapeutiques. Vu le risque rythmique théorique, une surveillance par Holter rythmique peut être discuté. La NCVG est une affection dont l’origine génétique est possible, mais hétérogène, avec des formes familiales et sporadiques. De nombreuses mutations ont été identifiées sur plusieurs gènes dans la NCVG. Ce diagnostic impose donc d’adresser le patient à un centre de référence ou de compétence des cardiomyopathies rares afin d’envisager un conseil génétique et éventuellement une analyse génétique. En raison de la possibilité de formes familiales, un dépistage échocardiographique systématique des apparentés du 1er degré est recommandé. En l’absence de gène identifié chez le cas index, un ECG et une échocardiogaphie sont recommandés chez les apparentés du 1er degré, dès la naissance et répétés tous les 2 ans avant l’âge de 20 ans, tous les 2 à 5 ans après 20 ans, jusqu’à l’âge de 50 à 60 ans. Si une mutation est identifiée chez le cas index, une analyse génétique doit être pratiquée chez les apparentés du 1er degré et dictera leur surveillance cardiologique ultérieure.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :