Publié le 01 sep 2017Lecture 16 min
Comment prévenir les accidents vasculaires cérébraux ?
Benjamin MAÏER*, Mikael MAZIGHI*/**
L’accident vasculaire cérébral (AVC), représente la première cause de handicap, la deuxième cause de mortalité et de démence(1).
L’AVC en quelques chiffres
L’accident vasculaire cérébral (AVC), représente la première cause de handicap, la deuxième cause de mortalité et de démence(1). En France, l’incidence annuelle des AVC est de 100 000 à 145 000 cas par an, avec 15-20 % de mortalité au terme du premier mois, 60 % de mortalité à 5 ans, et 50 % de survivants avec séquelles(2). L’AVC recouvre les infarctus cérébraux (IC) et les hémorragies cérébrales (HC), représentant respectivement 80 % et 20 % d’entre eux.
Une des spécificités des AVC est l’hétérogénéité de leurs causes (figure 1).
Figure 1. Les causes des infarctus cérébraux sont dominées par les causes cardio-emboliques, la maladie des petites artères et l’athérothrombose.
Les trois principales causes des IC sont représentées par l’athérothrombose, les cardiopathies emboligènes et la maladie des petites artères (MPA) (figure 2). À noter que pour 20 à 25 % des patients, aucune cause n’est identifiée. Pour les sujets les plus jeunes de moins de 50 ans, la situation est différente puisque la dissection des artères cervicales reste la principale cause d’IC et l’absence de cause peut atteindre 45 % des patients. En ce qui concerne les HC, la topographie a un rôle clé dans la démarche étiologique (par exemple, l’HC localisée dans les noyaux gris centraux est plus fréquente chez les patients avec une MPA, alors que les HC lobaires récidivantes sont en faveur de l’angiopathie amyloïde chez les personnes âgées). Ces quelques exemples montrent la diversité des pathologies rencontrées, qui viennent souligner des prises en charge différentes.
Figure 2. IRM cérébrale en coupe axiale montrant des lésions de MPA. Séquence FLAIR identifiant des hypersignaux de la substance blanche périventriculaires (flèches noires).
Prévention de l’infarctus cérébral
Prise en charge des facteurs de risque vasculaire
Alors que les facteurs de risque vasculaire sont communs à la pathologie athérothrombotique coronaire et cérébrale, l’HTA est le principal d’entre eux pour les AVC. Elle multiplie le risque d’IC par 4(3). Ce risque augmente pour des valeurs élevées de pression artérielle (PA) systolique, diastolique et de variabilité tensionnelle(4,5). L’HTA est notamment impliquée dans la MPA, à l’origine d’IC profonds de petite taille, pouvant être silencieux et responsables à plus long terme d’un déclin cognitif. En prévention secondaire, de nombreux essais thérapeutiques ont démontré l’impact d’une réduction de la PA pour prévenir une récidive ischémique de près de 20 % (RR : 0,81 ; IC95% : 0,73- 0,91)(6-8). L’étude PROGRESS qui a évalué la baisse de PA après un AVC (IC et HC) chez des sujets hypertendus ou non hypertendus, a montré qu’une réduction de 12/5 mmHg a été associée à une réduction relative de 43 % du risque d’AVC
Un des grands messages de cette étude est que le bénéfice de la réduction de la PA existe chez le normotendu et l’hypertendu après un AVC quel qu’en soit le type.
De fait, pour les patients qui récidivent sous la forme d’un AVC sans étiologie identifiée, il est proposé une prise en charge plus intensive de la PA même s’ils sont normotendus.
Actuellement, un traitement antihypertenseur est envisagé pour tout patient ayant un IC ou un accident ischémique transitoire (AIT) lorsque la PA systolique est supérieure ou égale à 140 mmHg et la diastolique supérieure à 90 mmHg(9). Les antihypertenseurs recommandés en prévention secondaire sont les inhibiteurs de l’enzyme de conversion, les inhibiteurs calciques et les diurétiques thiazidiques(6,9,10).
Concernant le contrôle du diabète, la HAS recommande un objectif d’HbA1c ≤ 7 % pour tout patient diabétique avec des antécédents d’IC ou d’AIT de plus de 6 mois et ≤ 8 % pour tout IC et AIT de moins de 6 mois. La metformine étant un antidiabétique oral de première ligne à prescrire chez les patients diabétiques de type 2(11).
Il existe une relation complexe entre l’hypercholestérolémie et le risque d’IC. Un taux de LDLcholestérol (LDL-C) élevé est associé à une augmentation de l’incidence de certains types d’IC(12), notamment les IC de cause athérothrombotique ou les lacunes(13), tandis qu’un taux de LDL-C bas serait associé à un sur-risque d’HC(14,15). Alors que certaines études observationnelles ne montrent pas d’association entre un taux élevé de LDL-C et le risque d’IC(16), des données de métaanalyses d’études randomisées évaluant les statines ont permis de montrer que celles-ci réduisent significativement le risque d’IC(17). SPARCL(18) a été la première étude à montrer que le traitement par statine à forte dose (atorvastatine 80 mg/j) réduisait de manière significative le risque de récidive ischémique chez les patients atteints d’un AIT ou IC non cardio-embolique. Dans cette étude, le LDL-C moyen a été de 0,73 g/l dans le bras atorvastatine versus 1,29 g/l dans le bras placebo. La réduction du risque de récidive d’AVC a été de 16 % et de 35 % pour les événements coronariens par rapport au placebo. À noter que les patients avec une diminution de plus de 50 % du LDL-C ont vu leur risque de faire un AVC diminué de 31 %. Dans SPARCL, les patients sous atorvastatine 80 mg avaient également une réduction du risque de revascularisation carotide de l’ordre de 50 %.
Depuis cette étude, les statines sont indiquées, avec pour cible un LDL-C inférieur à 1,0 g/l, en prévention secondaire des IC non cardio-emboliques. Dans la situation particulière de l’athérothrombose intracrânienne symptomatique, la cible pour le LDL-C est alors inférieure à 0,7 g/l (cf. infra)(19).
La prise en charge des facteurs de risque vasculaire passe également par une lutte contre l’inactivité physique, qui permet de réduire l’incidence des IC en cas de pratique régulière d’une activité sportive. Les recommandations nord-américaines proposent pour les patients souffrant d’AIT ou d’IC et capables d’une activité physique, de réaliser au moins 3 à 4 séances par semaine d’intensité modérée à importante(20).
Athérothrombose
L’athérothrombose est à l’origine de 25 % des IC. Les lésions les plus fréquentes et les mieux étudiées sont les sténoses symptomatiques de la carotide interne extracrânienne. D’autres sites peuvent être touchés, notamment la crosse aortique, les artères vertébrales et les artères cérébrales intracrâniennes.
Pour les sténoses carotides extracrâniennes, deux grandes situations cliniques doivent être envisagées : la sténose symptomatique et la sténose asymptomatique.
• Sténose symptomatique de la carotide interne extracrânienne
Pour les sténoses de 70 % à 99 % de la carotide interne responsables d’un AIT carotidien ou un IC homolatéral de moins de 6 mois, il est recommandé de réaliser une endartériectomie carotide en complément du traitement médical maximal(21-24). À noter, qu’il n’y a pas de bénéfice à la revascularisation lorsque la carotide est occluse. Ce geste de revascularisation doit être réalisé précocement dans les 15 jours après l’événement cérébro-vasculaire (en raison du risque de récidive précoce), par une équipe spécialisée dont le risque périopératoire et la mortalité sont inférieurs à 6 %, (HAS 2015, Accord d’Experts). Pour les sténoses symptomatiques de 50 à 69 %, le bénéfice de la revascularisation est moins net et doit prendre en considération certaines caractéristiques du patient et de l’IC.
Le bénéfice paraît plus important pour les hommes, âgés de plus de 75 ans, et en cas de symptômes hémisphériques (par exemple, aphasie, hémiplégie par opposition aux symptômes rétiniens).
Il faut souligner ici que le bénéfice est le plus important chez les plus âgés, il n’y a donc pas de raison pour exclure ces patients de la chirurgie bien au contraire, car il s’agit de la population à plus haut risque de récidive. Pour les sténoses carotides inférieures à 50 %, il n’a pas de place pour la revascularisation.
L’alternative à l’endartériectomie est le traitement endovasculaire par stenting, évalué par de nombreux essais thérapeutiques(25). Ces études ont montré que le risque périprocédural d’IC et de mortalité est augmenté dans le groupe stenting (8,2 vs 5,0 ; OR : 1,72 ; IC95% : 1,29- 2,31), et dans le sous-groupe des patients de plus de 70 ans (OR : 2,20 ; IC95% : 1,47-2,39). Toutefois, pour les patients de moins de 70 ans, il existe une équivalence entre les deux techniques. En pratique, le stenting carotide est envisageable pour les patients de moins de 70 ans, mais en France, il est le plus souvent proposé en deuxième intention, dans les situations suivantes : accès chirurgical complexe, sténose carotide postradique, sténose carotide postendartériectomie, ou toute autre situation rendant le geste chirurgical complexe et risqué.
• Sténose carotide asymptomatique
La problématique est ici différente du fait de l’absence de symptomatologie ischémique carotide constituée ou transitoire. Les études évaluant la chirurgie au traitement médical seul ont montré dans les années 1990, que la revascularisation pouvait être bénéfique après 5 ans de suivi pour les sténoses > 60 % avec un taux d’événements cérébro-vasculaires de 2 %/an. Mais les données plus récentes suggèrent un risque plus faible, des sténoses carotides asymptomatiques, évalué désormais de 0,5 à 1 % par an(26,27), ce qui alimente de nombreux débats sur la prise en charge de ces patients.
La revascularisation est le plus souvent réservée aux sténoses carotides à haut risque d’IC (sévérité et progression de la sténose, emboles asymptomatiques, infarctus carotidiens silencieux, morphologie de la plaque carotide, etc.) avec un risque périopératoire (IC, infarctus du myocarde et de mortalité) qui doit être faible et inférieur à 3 %(28).
Pour les patients à haut risque opératoire, il n’y a pas de preuve de supériorité de la revascularisation carotide par rapport au traitement médical maximal. Le risque d’événement cérébrovasculaire diminuant avec l’amélioration de la prise en charge des facteurs de risque vasculaire, l’enjeu est désormais d’évaluer la revascularisation chez les patients à plus haut risque de récidive. À l’inverse des sténoses symptomatiques, l’âge avancé n’est pas en faveur de la revascularisation et une espérance de vie de plus de 5 ans est habituellement requise pour envisager un bénéfice de cette stratégie interventionnelle.
• Athérothrombose intracrânienne
L’athérothrombose intracrânienne a la particularité d’être associée à un haut risque de récidive d’AVC pouvant atteindre plus de 20 % par an(19). Ces patients sont à risque de récidive cérébro-vasculaire les premières semaines, mais également d’événements coronariens à moyen terme. Pour cette raison, cette population de patients doit avoir un bilan de la maladie coronaire. La prise en charge de l’athérothrombose intracrânienne symptomatique repose sur un traitement médical uniquement, car l’approche endovasculaire est délétère en raison d’une sur-morbi-mortalité qu’elle engendre(19,29). Le traitement médical associe une double antiagrégation plaquettaire pendant 3 mois suivie d’une simple antiagrégation et un traitement hypocholestérolémiant avec pour objectif un LDL-C inférieur à 0,7 g/l(19). Cette cible pour le LDL-C est différente de celle pour les IC non cardio-emboliques (1 g/l), car elle repose sur les données de l’étude randomisée SAMMPRIS, dont le design comprenait un traitement médical dit « intensif » en raison du risque élevé de récidive de l’athérothrombose intracrânienne.
Cardiopathies emboligènes
Il existe de nombreuses causes cardiaques à l’origine d’IC, mais elles sont largement dominées par la fibrillation atriale (FA). La FA représente, en effet, un quart des causes d’IC. L’IC consécutif à la FA est souvent associé à une mortalité plus importante et un surcroît de handicap(30).
Un des enjeux actuels est que 25 % de ces IC représentent la première manifestation d’une FA méconnue.
Ce risque est associé à tous les types de FA, paroxystique, persistante ou permanente(31). Autour de 20-25 % des IC ont un bilan étiologique négatif et sont dits cryptogéniques ou nouvellement nommés ESUS (Embolic Stroke of Undetermined Source). Un nombre important de patients dits « ESUS » ont une FA non diagnostiquée, à haut risque de récidive ischémique(32). Dans ce contexte, la recherche d’un trouble du rythme supraventriculaire doit se faire de manière prolongée chez ces patients, mais avec une rentabilité qui reste, malgré tout faible (au mieux de 30 % de FA diagnostiquée après 30 jours de monitoring cardiaque)(33).
Dans plusieurs métaanalyses, les anti-vitamine K (AVK) avec la warfarine ont montré une diminution de 64 % d’IC ou emboles systémiques et une réduction de 26 % de la mortalité contre placebo(34,35). Parmi les stratégies antithrombotiques, l’aspirine n’a plus sa place dans la prévention de l’IC en cas de FA(36). Il importe de dépister les patients décrits à faible risque(37) afin de proposer un traitement par anticoagulation orale à ceux présentant au moins un facteur de risque d’IC supplémentaire (CHA2DS2VASc ≥ 1). De manière conjointe, le risque hémorragique est à évaluer par l’intermédiaire de scores (par exemple, HAS-BLED). Un sur-risque hémorragique ne doit, la plupart du temps, pas contre-indiquer la prescription d’une anticoagulation préventive car le risque d’IC et ses conséquences dépassent le plus souvent le risque hémorragique. Il doit par contre bien sûr entraîner une surveillance plus accrue et une adaptation thérapeutique.
Parmi les situations contre-indiquant tout traitement antithrombotique à connaître, il y a l’angiopathie amyloïde qui sera détaillée plus tard.
Les AVK sont efficaces et sûrs s’ils sont bien utilisés. Cela sous-entend une zone thérapeutique pour l’INR entre 2 et 3 dans plus de 70 % des cas(38), cible parfois difficile à atteindre en pratique clinique. De nombreux facteurs peuvent modifier l’équilibre du traitement AVK, ces facteurs étant incorporés dans le score SAMe-TT2R2(39). D’une valeur prédictive modeste, ce score permet tout de même de dépister avant traitement les patients qui seront difficiles à équilibrer sous AVK (score > 2) et à risque élevé de complications thromboemboliques, hémorragiques, et de mortalité. Ces patients justifient une prise en charge plus rapprochée pour l’équilibre de l’AVK ou l’utilisation d’un anticoagulant oral direct (AOD).
Sur la base de métaanalyses qui ont repris les différents essais thérapeutiques évaluant les AOD contre les AVK :
Les AOD paraissent supérieurs à la warfarine avec le dabigatran 150 mg dans l’étude RE-LY (OR : 0,66 ; IC95% : 0,53-0,82) ou l’apixaban dans l’étude ARISTOTLE (comparaison apixaban vs warfarine, OR : 0,79 ; IC95% : 0,66-0,95) dans la réduction du risque d’AVC ou emboles systémiques.
Cette réduction du nombre d’AVC est d’abord consécutive à une diminution du taux d’AVC hémorragiques. Une réduction du risque significative pour les IC n’a été montrée que pour le dabigatran 150 mg.
Le dabigatran 110 mg, l’apixaban et l’edoxaban étaient plus sûrs que les AVK dans ces études et le dabigatran 150 mg était aussi sûr que la warfarine concernant les hémorragies majeures.
Le taux de saignement intracrânien ou fatal était rare, la principale complication des AOD étant le saignement digestif, plus fréquent que pour les AVK.
Le choix de l’AOD à utiliser dépend du profil clinique du patient (fonction rénale, risque de saignement digestif, score HAS-BLED, posologie en une prise ou double). Une récente revue de la littérature sur la prévention des patients souffrant de FA propose ainsi un choix d’AOD en fonction du profil du patient(36).
Maladies des petites artères (MPA)
Impliquée dans 25 % des IC, la MPA est une cause importante à connaître. La MPA incarne un très large spectre d’étiologies : pouvant être acquises par l’intermédiaire de l’HTA, du diabète ou génétique comme la maladie de CADASIL (Cerebral Autosomic Dominant Arteriopathy with Subcortical Infarcts and Leukoencephalopathy). Cette cause est également impliquée dans la pathologie hémorragique (cf. infra) et neuro-dégénérative (démence vasculaire, ou démence mixte avec la maladie d’Alzheimer).
La MPA touche majoritairement les territoires vascularisés par les artères perforantes de petit calibre. Du point de vue étiologique, plusieurs mécanismes complexes peuvent être impliqués dans la MPA, dominés par la lipohyalinose (épaississement de la paroi vasculaire des artères perforantes) consécutive à l’HTA et à l’âge.
En neuro-imagerie, tout un spectre lésionnel peut être observé en incluant des IC sous-corticaux de petite taille inférieure à 20 mm à la phase aiguë, des lacunes qui sont des lésions ovoïdes, sous-corticales, cavitaires (remplie de liquide cérébro- spinal), mesurant entre 3 et 15 mm, séquelle d’un IC souscortical de petite taille ou d’une hémorragie cérébrale dans le territoire d’une artère perforante(40). Les mesures de prévention sont centrées sur le contrôle des facteurs de risque vasculaire, puisqu’il n’existe pas de mesure de prévention à ce jour pour les autres causes de MPA, notamment génétique.
Dissections cervicales
Les dissections cervicales peuvent être sous-intimales (rétrécissant la lumière artérielle) ou sous-adventitielles (dilatation artérielle).
Elle représente une des premières causes à évoquer dans les IC du sujet jeune de moins de 45 ans (environ 20 % des cas).
Les dissections de la carotide interne sont les plus fréquentes, situées classiquement au-dessus du bulbe carotide ou juste avant l’entrée dans le crâne (segment sous-pétreux). Elles peuvent également toucher les artères vertébrales, notamment dans leur segment V3 (segment mobile contournant les vertèbres C1 et C2). Elles sont objectivées sur des séquences de neuro-imagerie spécifiques permettant de visualiser l’hématome de paroi : séquence T1 avec saturation du signal de la graisse à l’étage cervical.
La plupart des dissections sont spontanées ou traumatiques (consécutives à des manipulations rachidiennes cervicales, accident de la voie publique, etc.).
Le mécanisme de l’ischémie cérébrale peut être double, la plupart du temps lié à un embole d’artère à artère formé au niveau de la brèche intimale, mais il peut être également hémodynamique. Les recommandations de la HAS proposent la prescription d’un traitement antithrombotique pour prévenir l’IC. La décision du traitement (anticoagulant ou antiagrégant plaquettaire) est à prendre au cas par cas en fonction des caractéristiques cliniques, radiologiques et des comorbidités, mais il n’y a pas de supériorité d’une anticoagulation curative comparée à l’aspirine concernant la diminution du risque de récidive ou de survenue initiale d’un IC. À noter que l’arrêt du traitement antithrombotique est possible après normalisation du calibre artériel, alors qu’un traitement antiagrégant plaquettaire au long cours sera maintenu en cas de sténose persistante ou de dilatation anévrismale résiduelle.
Prévention de l’hémorragie cérébrale
L’HC représente environ 20 % des AVC. Contrairement aux IC, les HC ne répondent pas à une systématisation artérielle, et leur symptomatologie dépend de la topographie de l’hématome (profond ou superficiel). Aucun élément clinique ne permet de distinguer une HC d’un IC, ce qui explique la nécessité d’une imagerie cérébrale devant tout événement neurologique compatible avec un AVC. Il existe de multiples causes d’HC, mais seules deux d’entre elles seront abordées ici : la MPA et l’angiopathie amyloïde cérébrale, deux pathologies dont la fréquence augmente avec l’âge. D’une façon générale, la prise en charge des HC pour prévenir la récidive hémorragique est déterminée par l’étiologie : traitement d’une malformation vasculaire, éviction des toxiques, anticoagulation en cas de thrombose veineuse cérébrale…
Hémorragies liées à la maladie des petites artères (MPA)
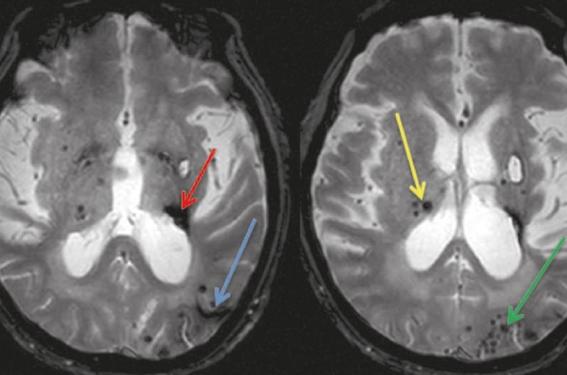
Comme décrit précédemment, la MPA correspond à un très large spectre d’étiologies (acquises comme génétiques), pouvant s’exprimer sur le versant ischémique et/ou hémorragique. L’HTA est le principal facteur de risque associé aux HC(41). La topographie des hématomes liés à l’HTA est classiquement profonde, dans les noyaux gris centraux(42). L’IRM cérébrale, montre souvent d’autres stigmates cérébraux de la maladie hypertensive (hypersignaux de la substance blanche compatible avec une leucopathie vasculaire, microsaignements souvent profonds, figure 3). Dans cette situation, la prévention primaire et secondaire se rapproche des recommandations de la Société française d’hypertension artérielle avec l’obtention d’une PA systolique entre 130 et 139 mmHg et une PA diastolique < 90 mmHg à 6 mois du diagnostic de l’HTA, confirmées par des automesures à domicile. La prise en charge des autres facteurs de risque vasculaire est également nécessaire.
Figure 3. IRM cérébrales chez un patient souffrant de MPA mixte : microangiopathie hypertensive et angiopathie amyloïde. À gauche, IRM cérébrale en séquence T2* montrant une séquelle d’hémorragie capsulo-thalamique gauche (hyposignal flèche rouge), une hémosidérose corticale temporale gauche (flèche bleue) et de nombreux microsaignements corticaux temporo-occipitaux gauches et profonds. À droite, IRM cérébrale en séquence T2* montrant de nombreux microsaignements occipitaux gauches, corticaux (flèche verte), et quelques microsaignements profonds (flèche jaune).
Angiopathie amyloïde cérébrale
L’angiopathie amyloïde cérébrale correspond à des dépôts de peptides bêta-amyloïdes au niveau de la paroi des artères de petits et moyens calibres et des artères leptoméningées.
Le plus souvent asymptomatique avant l’apparition d’une complication, cette cause représente la principale cause d’HC lobaire du sujet âgé(43) (figure 3).
Différentes formes existent, allant des formes génétiques, sporadiques beaucoup plus fréquentes, et de rares formes d’angiopathie amyloïde inflammatoire. La prévalence de cette affection a pu être estimée sur des biopsies cérébrales lors d’évacuation d’hématomes. Une angiopathie amyloïde modérée à sévère était présente chez 2,3 % des patients de 65 à 74 ans, 8,0 % chez les patients de 75 à 84 ans et 12,1 % chez les patients de plus de 85 ans(44). Ce diagnostic d’angiopathie amyloïde est basé sur des critères diagnostiques cliniques et radiologiques (critères de Boston). Mais le diagnostic de certitude reste anatomo-pathologique. L’IRM cérébrale est d’une grande aide pour orienter le praticien, une angiopathie amyloïde étant évoquée devant la présence de microsaignements lobaires, corticaux, d’hypersignaux de la substance blanche, d’hémosidérose corticale (témoins d’anciennes micro-hémorragies sous-arachnoïdiennes asymptomatiques). L’HC est majoritairement de topographie lobaire(45). Il n’existe pas à ce jour de mesure préventive de l’angiopathie amyloïde. Son diagnostic doit en revanche contre-indiquer formellement tout traitement antithrombotique à vie du fait de l’important risque hémorragique. Cette situation doit également s’appliquer à la FA où une fermeture de l’auricule devra être discutée.
Références sur demande à la rédaction : biblio@axis-sante.com
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :