Insuffisance cardiaque
Publié le 15 avr 2019Lecture 10 min
Quelle place pour l’IRM dans l’insuffisance cardiaque ?
David PESENTI-ROSSI, CMC Ambroise Paré, Neuilly-sur-Seine
Le domaine de l’IRM cardiovasculaire a évolué rapidement au cours de la dernière décennie, autorisant de nouvelles applications dans un large spectre de domaines cliniques et de recherche. Les progrès technologiques en termes de champs magnétiques, et les développements clés tels que l’imagerie de perfusion ultra-rapide, l’imagerie de rehaussement tardif et les séquences de cartographie ont contribué à une révolution dans la façon de diagnostiquer et traiter les cardiopathies ischémiques et non ischémiques. Dans l’insuffisance cardiaque, l’IRM joue un rôle important dans le bilan étiologique, pronostic, et pour guider les décisions thérapeutiques.
L'IRM cardiaque est devenue la technique d’imagerie de référence pour l’étude de la fonction ventriculaire gauche et droite, pour la détection et la caractérisation de nombreuses formes des cardiomyopathies ischémiques ou non, des cardiopathies congénitales, des masses cardiaques, du péricarde et des gros vaisseaux.
Quand penser à l’IRM dans l’insuffisance cardiaque ?
Dans l’insuffisance cardiaque, la fonction systolique ventriculaire gauche (VG) a un rôle diagnostique et pronostique. D’une manière générale, l’échocardiographie est l’examen de choix pour l’étude de la fonction VG, mais l’IRM, en raison de l’acquisition de données en trois dimensions, est considérée comme plus précise et reproductible.
Pour le diagnostic des patients dont une insuffisance cardiaque est suspectée, l’IRM est classe IC des recommandations de l’European Society of Cardiology (ESC) HF Guidelines(1).
Le registre multicentrique de l’European CMR(2) concerne plus de 2 700 patients inclus dans 57 centres et 15 pays. Dans ce registre, les indications les plus importantes sont la stratification du risque en cas de suspicion de coronaropathie/ischémie (34,2 %), la myocardite/cardiomyopathies (32,2 %) et l’évaluation de la viabilité (14,6 %). En pratique, ces indications correspondent à 80 % des causes d’insuffisance cardiaque.
Dans ce registre, la qualité des images est diagnostique dans plus de 98 % des cas.
Des complications graves sont rares, 0,026 %, toujours associées aux IRM de stress. Aucun patient n’est décédé pendant ou en raison de l’IRM.
Sur un plan étiologique et décisionnel, dans 61,8 % des cas, les résultats de l’IRM ont eu une incidence sur la gestion des patients (nouveau diagnostic et/ou conséquences thérapeutiques). Fait important, dans près de 8,7 % des cas, le diagnostic final basé sur l’IRM était différent du diagnostic avant IRM, conduisant à un changement complet de la prise en charge.
Les conséquences thérapeutiques après l’IRM cardiaque : changement dans le traitement (25 %) ; procédure invasive (16,8 %) ; sortie de l’hôpital (10,2 %) ; et admission à l’hôpital (1,4 %).
Sur un plan pronostique, l’analyse intermédiaire a révélé un faible taux d’événements chez les patients suspects de coronaropathie avec une IRM de stress normale (1,0 % par an) et chez les patients atteints de cardiopathie hypertrophique sans rehaussement tardif (2,7 % par an).
L’IRM cardiaque en pratique ?
L’IRM cardiaque est un examen devenu très accessible. Brièvement, cette méthode d’imagerie est non irradiante et consiste à exposer le patient à un champ magnétique de haute intensité (actuellement 1,5 et 3 Tesla). Il est nécessaire, pour réaliser une IRM cardiaque de qualité, de disposer d’une équipe qualifiée formée aux spécificités de cet examen. Les manipulateurs sont, à ce titre, un maillon essentiel dans le processus aboutissant à un examen de qualité. Après avoir vérifié l’absence de contre-indication, le patient doit être auparavant informé sur la durée de l’examen (20 à 30 min), le confinement dans la machine et les apnées parfois prolongées.
Les contre-indications ?
Les contre-indications de l’IRM sont liées essentiellement aux champs magnétiques utilisés. Les contre-indications absolues à la réalisation d’une IRM sont :
– le port de stimulateurs ou défibrillateurs cardiaques hormis les stimulateurs IRM compatibles introduits récemment sur le marché qui permettent la réalisation d’IRM cardiaques avec une qualité d’imagerie satisfaisante. En revanche, la réalisation nécessite la présence d’un rythmologue pour la programmation en mode spécifique et des systèmes 1,5 T pour ces dispositifs ont été développés ;
– le port de neurostimulateurs, les clips neurochirurgicaux (posés depuis moins d’1 mois ou datant de plus de 10 ans), les corps étrangers métalliques intraorbitaires, le port d’une valve cardiaque de type Starr Edwards (Pre 6000) qui n’est plus utilisée depuis 20 ans, le port de certaines prothèses cochléaires.
La comptabilité des dispositifs peut être vérifiée sur : www.mrisafety.com
Les contre-indications relatives sont la classique claustrophobie moins problématique avec les tunnels larges, l’agitation ou l’absence de coopération prévisible.
Gold standard de l’évaluation VG/VD
Dans l’insuffisance cardiaque, la fonction systolique ventriculaire gauche (VG) a un rôle diagnostic et pronostic. L’IRM cardiaque est considérée comme le gold standard dans l’évaluation qualitative et quantitative de la fonction ventriculaire gauche globale et régionale. Ces indications ont un intérêt en cas de résultats d’échocardiographie indéterminés ou discordants dans l’évaluation de la fonction ventriculaire gauche, en particulier après un infarctus du myocarde. Cette évaluation régionale utilise le modèle de 17 segments standard. Cette analyse fonctionnelle est basée sur les séquences cinétiques.
Elles permettent de déterminer des paramètres cardiaques tels que la masse ventriculaire, la cinétique régionale, les fractions d’éjection VG et VD (FEVG et FEVD). Elles sont généralement réalisées avant injection pour optimiser le contraste entre le myocarde et le sang.
Évaluation des cardiopathies ischémiques
L’objectif principal de l’IRM dans la cardiopathie ischémique est d’identifier l’infarctus du myocarde aigu pour différencier le myocarde viable et le myocarde non viable(3).
Cette analyse repose sur l’imagerie de perfusion. Ces séquences sont pratiquées pendant l’injection d’un chélate de Gadolinium à fort débit et faible dose.
Elles analysent le premier passage du gadolinium injecté via une veine périphérique, grâce à des séquences ultrarapides. Cette imagerie permet l’analyse de la perfusion myocardique pour détecter les zones anormales de perfusion au repos ou lors d’un stress induit pharmacologiquement. En cas d’hypoperfusion, les segments myocardiques sont en hyposignal. Dans le cadre de la maladie coronaire, on peut distinguer l’ischémie myocardique chronique et la viabilité évaluées par l’utilisation d’agents pharmacologiques. L’IRM peut aussi être effectuée avec des agents de stress vasodilatateurs, tels que l’adénosine qui est la plus utilisée avec la meilleure tolérance et sensibilité pour détecter une ischémie inductible.
L’indicateur le plus fiable de l’infarctus aigu du myocarde est le rehaussement tardif après l’administration par voie intraveineuse de produit de contraste à base de gadolinium (figure 1).
Figure 1. Caractéristiques de la perfusion de premier passage/Rehaussement tardif. Dans le myocarde sain, l’élimination du gadolinium est rapide.
Les séquences de rehaussement tardif sont réalisées 10 minutes après l’injection de Gadolinium, ces séquences sont destinées à identifier les zones de nécrose, d’inflammation ou de fibrose. Dans ces zones, le « wash-out » (lavage) du gadolinium est ralenti, il s’accumule en raison d’une rupture des membranes cellulaires ce qui se traduit par un hypersignal (blanc), le myocarde normal est au contraire en noir. Les études après infarctus du myocarde ont montré une bonne corrélation entre l’importance du rehaussement tardif et le degré de tissu myocardique atteint, comparé au myocarde sain. Ainsi, le rehaussement tardif est associé à une nécrose des myocytes dans le cadre du myocarde aigu et chronique. En revanche, le myocarde « à risque » et en cas de lésion ischémique sévère réversible (même en cas de stunning) ne présente pas de rehaussement tardif.
Un rehaussement tardif sous-endocardique ou transmural est caractéristique.
Il permet de la distinguer des autres causes de rehaussement telles que les myocardites et les cicatrices des cardiopathies non ischémiques.
Enfin, une extension transmurale de l’infarctus, impliquant > 50 % de l’épaisseur de la paroi peut prédire des régions qui sont moins susceptibles de récupérer après revascularisation coronaire ou bêtabloquante selon les cas.
L’angiographie IRM coronaire : bien que l’IRM puisse analyser les coronaires sans agent de contraste et sans irradier, elle peut surtout explorer les segments coronaires proximaux. Son application clinique est toujours limitée à la recherche d’une anomalie de naissance des coronaires, car sa résolution spatiale est limitée, en particulier par rapport au scanner.
Évaluation des cardiomyopathies non ischémiques
Classiquement, la séquence de référence est également le rehaussement tardif myocardique, caractéristique spécifique de l’IRM cardiaque qui peut être extrêmement utile pour détecter les zones de lésions du myocarde et de fibrose, et les différencier des zones de nécrose des cardiopathies ischémiques.
Bien que le rehaussement tardif puisse être visualisé en scanner, le rapport signal/bruit est meilleur en IRM (figure 2). Le rehaussement tardif peut être vu dans les maladies autres que les infarctus aigus et chroniques. Il s’agit notamment de la sarcoïdose, la cardiomyopathie dilatée et hypertrophique, la myocardite, l’amylose, et la dysplasie arythmogène du ventricule droit. Dans ces indications, les caractéristiques de ces troubles sont différentes du rehaussement sous-endocardique ou transmural vu dans l’infarctus. Par exemple, le rehaussement peut avoir une localisation médiopariétale ou sous-épicardique.
Figure 2. Caractéristiques du rehaussement tardif selon l’atteinte myocardique, ischémique ou non(4).
Dans les cardiomyopathies dilatées primitives, c’est en particulier l’absence d’hypersignal sousendocardique ou transmural sur les séquences de rehaussement tardif qui permettra d’éliminer l’origine ischémique.
Dans les cardiopathies hypertrophiques, l’IRM est considérée comme l’examen de référence dans l’évaluation de la masse myocardique, car il est plus précis et reproductible que l’échocardiographie. En particulier, les patients atteints de cardiomyopathie hypertrophique atypique, telle que l’hypertrophie apicale, peuvent être mieux évalués par IRM que par l’échocardiographie. Le rehaussement tardif permet d’évaluer l’importance de l’infiltration fibreuse et a un caractère pronostique. L’hypersignal, localisé dans la région médio-ventriculaire, n’est retrouvé la plupart du temps que dans les zones hypertrophiques et prend un aspect nodulaire irrégulier, le plus souvent à localisations multiples. Les séquences de rehaussement tardif permettent de visualiser l’infiltration du myocarde par de la fibrose ou par d’autres tissus, comme en cas de sarcoïdose ou d’amylose.
Dans les myocardites, les séquences de rehaussement tardif mettent en évidence des hypersignaux sous-épicardiques ou médio-ventriculaires, nodulaires ou linéaires en bandes.
Ces hypersignaux prédominent, lorsque l’origine est virale, dans la paroi inférolatérale de la région apicale du VG, et ne sont jamais localisées de façon isolée au sous-endocarde, permettant d’éliminer un infarctus à coronaires saines. À distance, les hypersignaux régressent le plus souvent. Dans les myocardites chroniques, l’IRM de rehaussement tardif ne permet pas de différencier fibrose myocardique séquellaire et myocardite active. Seules les séquences pondérées T2 permettent le diagnostic d’une myocardite chronique active en visualisant un hypersignal T2 associé au rehaussement tardif.
L’IRM est également indiquée en cas de suspicion de dysplasie (DVDA) pour étudier la fonction ventriculaire droite globale et régionale et évaluer l’infiltration graisseuse du ventricule droit. Le rehaussement tardif des parois du VD est en faveur d’une transformation fibreuse du myocarde (figure 3). Il n’existe pas de signe pathognomonique de DVDA. Le diagnostic est établi, depuis 1994, sur la combinaison de critères majeurs et mineurs de Mac Kenna, modifiés en 2010 avec comme critère majeur une akinésie, dyskinésie ou désynchronisme de la contraction du VD et une des conditions suivantes : dilatation du VD ou une FEVD ≤ 40 %.
Figure 3. Caractéristiques du rehaussement tardif selon l’atteinte myocardique, ischémique ou non. Exemples : infarctus.
Des séquences morphologiques pour la caractérisation tissulaire ?
L’IRM est la principale modalité d’imagerie pour la caractérisation du tissu myocardique. De nouvelles séquences sont disponibles pour la caractérisation tissulaire : les paramètres de cartographie permettent la visualisation en routine des changements quantitatifs du myocarde basée sur des modifications des paramètres du myocarde T1, T2, T2* et ECV (fraction de volume extracellulaire). Ces changements incluent des anomalies spécifiques de pathologies cardiaques liées à des perturbations principalement intracellulaires du cardiomyocyte (par exemple, surcharge en fer ou accumulation de glycosphingolipide dans la maladie d’Anderson-Fabry) ; troubles extracellulaires dans l’interstitium du myocarde (par exemple, la fibrose myocardique de l’amylose cardiaque due à une accumulation de collagène ou de protéines amyloïdes, respectivement) ; ou œdème du myocarde et/ou infarctus avec œdème intracellulaire et/ou extracellulaire). Contrairement aux images pondérées en T1, T2 ou T2*, la cartographie permet à la fois une visualisation et une quantification du processus de la maladie, indépendamment du caractère focal ou diffus de l’atteinte myocardique.
La cartographie T1 peut être utilisée pour estimer la fraction de volume extracellulaire du myocarde (ECV), un marqueur de substitution validé de la fibrose basé sur la modification des valeurs de T1 suite à l’injection d’agents de contraste type gadolinium.
L’estimation de l’ECV nécessite des acquisitions répétées de T1 de base (T1 natif) et postcontraste (typiquement > 10 min après le contraste). L’ECV sera élevé en cas de volume extracellulaire augmenté (figure 4).
Figure 4. Exemples de séquences tissulaires : à gauche, syndrome de Takotsubo chez une patiente de 69 ans lors d’un stress aigu mimant un SCA avec akinésie apicale échographique (séquence T2 révélant un œdème apical et temps tardif normal). À droite, aspect normal de cartographie T1.
Les séquences et la cartographie T2 sont réalisées avant injection du chélate de gadolinium et permettent de visualiser un hypersignal lié à la présence d’œdème (figure 5). L’imagerie IRM pondérée en T2 est couramment utilisée pour évaluer l’inflammation du myocarde. Par ailleurs, dans l’hémochromatose, l’IRM peut être utilisée pour l’évaluation qualitative de la surcharge en fer myocardique ou d’une évaluation quantitative calculée en utilisant les valeurs du T2* du septum interventriculaire.
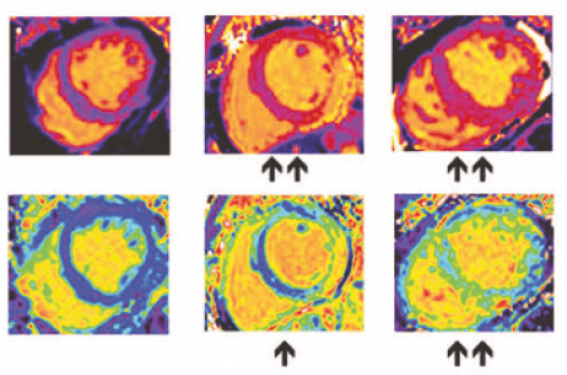
Figure 5. À gauche : protocole général pour l’analyse tissulaire et à droite : aspects caractéristiques des séquences et cartographie T1, T2, T2*, ECV des sujets sains et patients avec atteintes myocardiques. Les flèches indiquent les modifications relatives des différents paramètres. D’après Messroghli DR et al. J Cardiovasc Magn Reson 2017(5).
En pratique
Dans l’insuffisance cardiaque, l’IRM joue un rôle important dans le bilan étiologique, pronostique et pour guider les décisions thérapeutiques.
Pour le diagnostic des patients dont une insuffisance cardiaque est suspectée, l’IRM est classée IC des recommandations de l’ESC HF Guidelines .
Méthode de référence pour la cardiopathie ischémique (viabilité), cardiopathie dilatée, myocardite, cardiopathie hypertrophique.
Outil complémentaire à l’échographie.
Analyse morphologique et fonctionnelle.
Méthode de référence pour les volumes, masse et fraction d’éjection.
Caractérisation tissulaire (œdème, fibrose, fer...).
Outil pronostique : cardiopathie ischémique, cardiopathie hypertrophique...
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :